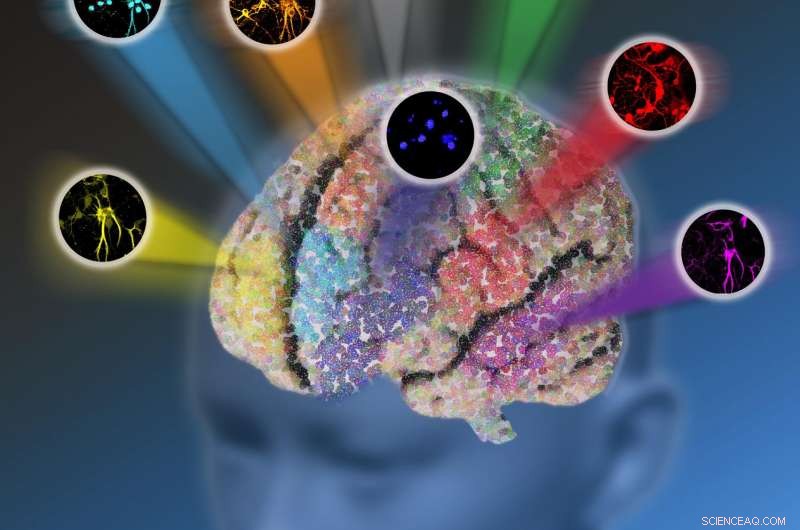
I ricercatori della Columbia University hanno sviluppato una nuova piattaforma di microscopia ottica chiamata microscopia a diffusione Raman stimolata dalla pre-risonanza elettronica (epr-SRS) che combina un alto livello di sensibilità e selettività. La tecnica innovativa consente l'imaging di fino a 24 strutture biomolecolari alla volta invece di essere limitata da sole cinque proteine fluorescenti. Crediti:Nicoletta Barolini, Università della Columbia
I ricercatori della Columbia University hanno compiuto un passo significativo verso la rottura della cosiddetta "barriera cromatica" della microscopia ottica per i sistemi biologici, consentendo un approccio molto più completo, etichettatura e imaging a livello di sistema di un numero maggiore di biomolecole nelle cellule e nei tessuti viventi di quanto sia attualmente ottenibile. Il progresso ha il potenziale per molte applicazioni future, compreso aiutare a guidare lo sviluppo di terapie per curare e curare le malattie.
In uno studio pubblicato online il 19 aprile in Natura , Il gruppo, guidato dal Professore Associato di Chimica Wei Min, segnala lo sviluppo di una nuova piattaforma di microscopia ottica con una sensibilità di rilevamento notevolmente migliorata. Inoltre, lo studio dettaglia la creazione di nuove molecole che, quando abbinato alla nuova strumentazione, consentono l'etichettatura e l'imaging simultaneo di un massimo di 24 biomolecole specifiche, quasi cinque volte il numero di biomolecole che possono essere visualizzate contemporaneamente con le tecnologie esistenti.
"Nell'era della biologia dei sistemi, come visualizzare simultaneamente un gran numero di specie molecolari all'interno delle cellule con elevata sensibilità e specificità rimane una grande sfida della microscopia ottica, Min ha detto. "Ciò che rende il nostro lavoro nuovo e unico è che ci sono due pezzi sinergici - strumentazione e molecole - che lavorano insieme per combattere questo ostacolo di lunga data. La nostra piattaforma ha la capacità di trasformare la comprensione di sistemi biologici complessi:la vasta mappa delle cellule umane, percorsi metabolici, le funzioni di varie strutture all'interno del cervello, l'ambiente interno dei tumori, e assemblaggio di macromolecole, per citarne solo alcuni."
Tutti i metodi esistenti per osservare una varietà di strutture nelle cellule e nei tessuti viventi hanno i loro punti di forza, ma tutti sono anche ostacolati da limitazioni fondamentali, non ultimo dei quali è l'esistenza di una "barriera di colore".

I ricercatori della Columbia University hanno sviluppato una nuova piattaforma di microscopia ottica chiamata microscopia a diffusione Raman stimolata dalla pre-risonanza elettronica (epr-SRS) che combina un alto livello di sensibilità e selettività. La tecnica innovativa consente l'imaging di fino a 24 strutture biomolecolari alla volta invece di essere limitata da sole cinque proteine fluorescenti. Crediti:Nicoletta Barolini, Università della Columbia
Microscopia a fluorescenza, Per esempio, è estremamente sensibile e, come tale, è la tecnica più utilizzata nei laboratori di biologia. Il microscopio consente agli scienziati di monitorare i processi cellulari nei sistemi viventi utilizzando proteine che sono generalmente chiamate "proteine fluorescenti" con solitamente fino a cinque colori. Ciascuna delle proteine fluorescenti ha una struttura bersaglio a cui applica un "tag, " o color to. Le cinque proteine fluorescenti, o colori, tipicamente usati per etichettare queste strutture sono BFP (Blue Fluorescent Protein), ECFP (proteina fluorescente ciano), GFP (proteina fluorescente verde), mVenus (proteina fluorescente gialla), e DsRed (proteina fluorescente rossa).
Nonostante i suoi punti di forza, la microscopia a fluorescenza è ostacolata dalla "barriera del colore, " che limita i ricercatori a vedere un massimo di sole cinque strutture alla volta perché le proteine fluorescenti utilizzate emettono una gamma di sfumature indistinguibili che, di conseguenza, rientrano in cinque grandi categorie di colori.
Se un ricercatore sta cercando di osservare tutte le centinaia di strutture e diversi tipi di cellule in un campione di tessuto tumorale cerebrale vivo, Per esempio, si sarebbe limitata a vedere solo fino a cinque strutture alla volta su un singolo campione di tessuto. Se voleva vedere più di quei cinque, avrebbe dovuto pulire il tessuto delle etichette fluorescenti che ha usato per identificare e contrassegnare le ultime cinque strutture per utilizzare quelle stesse etichette fluorescenti per identificare un altro insieme di massimo cinque strutture. Dovrebbe ripetere questo processo per ogni serie di massimo cinque strutture che desidera vedere. Non solo è osservare un massimo di cinque strutture alla volta ad alta intensità di lavoro, ma nella pulizia del tessuto, componenti vitali di quel tessuto potrebbero essere persi o danneggiati.
"Vogliamo vederli tutti allo stesso tempo per vedere come stanno operando da soli e anche come interagiscono tra loro, " disse Lu Wei, autore principale dello studio e ricercatore post-dottorato nel laboratorio Min. "Ci sono molti componenti in un ambiente biologico e dobbiamo essere in grado di vedere tutto contemporaneamente per comprendere veramente i processi".

I ricercatori della Columbia University hanno sviluppato una nuova piattaforma di microscopia ottica chiamata microscopia a diffusione Raman stimolata dalla pre-risonanza elettronica (epr-SRS) che combina un alto livello di sensibilità e selettività. La tecnica innovativa consente l'imaging di fino a 24 strutture biomolecolari alla volta invece di essere limitata da sole cinque proteine fluorescenti. Crediti:Nicoletta Barolini, Università della Columbia
Oltre alla microscopia a fluorescenza, ci sono attualmente una varietà di tecniche di microscopia Raman in uso per osservare le cellule viventi e le strutture dei tessuti che funzionano rendendo visibili le vibrazioni derivanti dai caratteristici legami chimici nelle strutture. La microscopia Raman tradizionale produce i colori altamente definiti che mancano nella microscopia a fluorescenza, ma manca la sensibilità. Come tale, richiede un forte, segnale vibrazionale concentrato che può essere raggiunto solo attraverso la presenza di milioni di strutture con lo stesso legame chimico. Se il segnale dei legami chimici non è abbastanza forte, visualizzare la struttura associata è quasi impossibile.
Per affrontare questa sfida, Min e la sua squadra, compresi i proff. Virginia Cornish in chimica e Rafael Yuste in neuroscienze, ha perseguito un nuovo ibrido di tecniche di microscopia esistenti.
Hanno sviluppato una nuova piattaforma chiamata microscopia a diffusione Raman stimolata dalla pre-risonanza elettronica (epr-SRS) che combina il meglio di entrambi i mondi, unendo un alto livello di sensibilità e selettività. La tecnica innovativa individua, con estrema specificità, strutture con concentrazione significativamente inferiore - invece di milioni della stessa struttura necessari per identificare la presenza di quella struttura nella microscopia Raman tradizionale, il nuovo strumento richiede solo 30 per l'identificazione. La tecnica utilizza anche una nuova serie di molecole di etichettatura progettate dal team per lavorare in sinergia con la tecnologia ultramoderna. La "tavolozza dei colori" amplificata delle molecole amplia le capacità di etichettatura, consentendo l'imaging di un massimo di 24 strutture alla volta invece di essere limitato da soli cinque colori fluorescenti. I ricercatori ritengono che ci sia il potenziale per un'ulteriore espansione in futuro.
Il team ha testato con successo la piattaforma epr-SRS nel tessuto cerebrale. "Siamo stati in grado di vedere le diverse cellule che lavorano insieme, " Wei ha detto. "Questo è il potere di una tavolozza di colori più ampia. Ora possiamo illuminare contemporaneamente tutte queste diverse strutture nel tessuto cerebrale. In futuro speriamo di vederli funzionare in tempo reale." Il tessuto cerebrale non è l'unica cosa per cui i ricercatori prevedono che questa tecnica venga utilizzata, lei ha aggiunto. "Diversi tipi di cellule hanno funzioni diverse, e gli scienziati di solito studiano solo un tipo di cellula alla volta. Con più colori, ora possiamo iniziare a studiare più cellule contemporaneamente per osservare come interagiscono e funzionano sia da sole che insieme in condizioni sane rispetto a stati patologici".
La nuova piattaforma ha molte potenziali applicazioni, Min ha detto, aggiungendo che è possibile che la tecnica possa un giorno essere utilizzata nel trattamento di tumori difficili da uccidere con i farmaci disponibili. "Se possiamo vedere come le strutture interagiscono nelle cellule tumorali, possiamo identificare modi per indirizzare strutture specifiche in modo più preciso, " ha detto. "Questa piattaforma potrebbe cambiare le regole del gioco nel tentativo di comprendere tutto ciò che ha molti componenti".