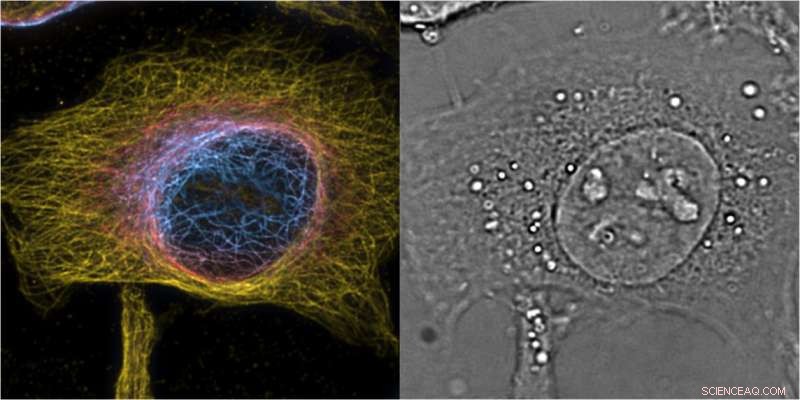
Proiezione di massima intensità delle cellule HeLa di bSOFI 3D di 2° ordine di microtubuli marcati, il colore codifica la posizione z con una fetta dell'immagine di fase 3D complementare che fornisce il contesto cellulare. Credito:T. Lasser/EPFL
La microscopia a super risoluzione è una tecnica in grado di "vedere" oltre la diffrazione della luce, fornendo viste senza precedenti delle cellule e delle loro strutture interne e organelli. La tecnica ha riscosso un crescente interesse di recente, soprattutto da quando i suoi sviluppatori hanno vinto il Premio Nobel per la Chimica nel 2014.
Ma la microscopia a super-risoluzione ha una grande limitazione:offre solo una risoluzione spaziale. Questo potrebbe essere sufficiente per i campioni statici, come materiali solidi o celle fisse, ma quando si tratta di biologia, le cose si complicano. Le cellule viventi sono altamente dinamiche e dipendono da un insieme complesso di processi biologici che si verificano in tempi inferiori al secondo, in continua evoluzione. Quindi, se vogliamo visualizzare e comprendere come funzionano le cellule viventi in condizioni di salute e malattia, abbiamo bisogno anche di una risoluzione temporale (o "temporale") elevata.
Un team guidato dal professor Theo Lasser, il capo del Laboratorio di ottica biomedica (LOB) dell'EPFL ha ora fatto passi da gigante per affrontare il problema sviluppando una tecnica in grado di eseguire sia la microscopia a super risoluzione 3D che l'imaging di fase 3D veloce in un unico strumento. L'imaging di fase è una tecnica che traduce i cambiamenti nella fase della luce causati dalle cellule e dai loro organelli in mappe dell'indice di rifrazione delle cellule stesse.
La piattaforma unica, che viene chiamato microscopio 4-D, combina la sensibilità e l'elevata risoluzione temporale dell'imaging di fase con la specificità e l'elevata risoluzione spaziale della microscopia a fluorescenza. I ricercatori hanno sviluppato un nuovo algoritmo in grado di recuperare le informazioni di fase da una pila di immagini in campo chiaro scattate da un microscopio classico.

PRISM:componente aggiuntivo per microscopia per eseguire l'imaging 3D simultaneo di 8 piani. Attestazione:Vytautas Navikas
"Con questo algoritmo, presentiamo un nuovo modo per ottenere la microscopia di fase quantitativa 3D utilizzando un microscopio a campo chiaro convenzionale, "dice Adrien Descloux, uno dei principali autori dell'articolo. "Ciò consente la visualizzazione diretta e l'analisi delle strutture subcellulari nelle cellule viventi senza etichettatura".
Per ottenere immagini 3D veloci, gli scienziati hanno progettato su misura un prisma che divide le immagini, che consente la registrazione simultanea di una pila di otto immagini z-spostate. Ciò significa che il microscopio può eseguire immagini di fase 3D ad alta velocità su un volume di 2,5 μm x 50 μm x 50 μm. La velocità del microscopio è sostanzialmente limitata dalla velocità della sua fotocamera; per questa dimostrazione, il team è stato in grado di visualizzare le dinamiche intracellulari fino a 200 Hz. "Con il prisma come add-on, puoi trasformare un microscopio classico in un imager 3D ultraveloce, "dice Kristin Grussmayer, un altro degli autori principali dell'articolo.
Il prisma è adatto anche per l'imaging a fluorescenza 3-D, che gli scienziati hanno testato utilizzando l'imaging a fluttuazione ottica (SOFI) a super risoluzione. Questo metodo sfrutta il lampeggio di coloranti fluorescenti per migliorare la risoluzione 3D attraverso l'analisi di correlazione del segnale. Usando questo, i ricercatori hanno eseguito l'imaging a super risoluzione 3D delle strutture colorate nelle cellule, e lo ha combinato con l'imaging di fase 3D privo di etichette. Le due tecniche si completavano molto bene, rivelando affascinanti immagini dell'architettura interna, citoscheletro, e organelli anche nelle cellule viventi in diversi punti temporali.
"Siamo entusiasti di questi risultati e delle possibilità offerte da questa tecnica, "dice il professor Hilal Lashuel, il cui laboratorio all'EPFL ha collaborato con il professor Lasser nell'utilizzo della nuova tecnica per studiare i meccanismi con cui l'aggregazione proteica contribuisce allo sviluppo e alla progressione delle malattie neurodegenerative, come il Parkinson e l'Alzheimer. "I progressi tecnici hanno consentito la visualizzazione ad alta risoluzione della formazione di aggregati patologici di alfa sinucleina nei neuroni dell'ippocampo".
Il team ha chiamato la nuova piattaforma di microscopia PRISM, per strumento Phase Retrieval con microscopia a super risoluzione. "Offriamo PRISM come un nuovo strumento di microscopia e anticipiamo che sarà rapidamente utilizzato nella comunità delle scienze della vita per espandere l'ambito dell'imaging 3D ad alta velocità per le indagini biologiche, " dice Theo Lasser. "Ci auguriamo che diventi un normale cavallo di battaglia per le neuroscienze e la biologia".