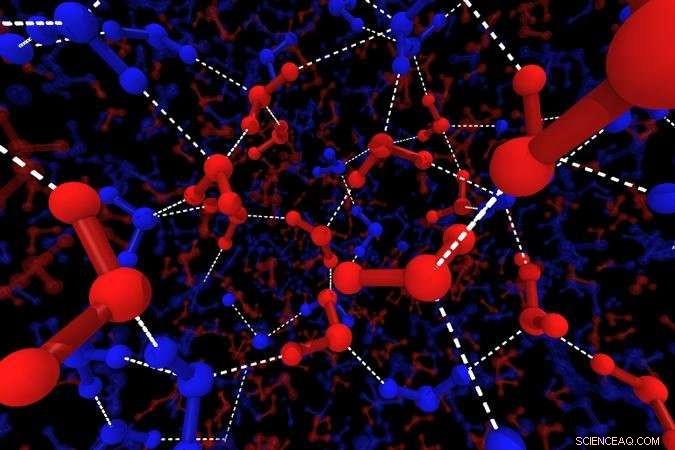
Illustrazione delle strutture locali dell'acqua. Le linee blu mostrano le molecole di H2O di struttura tetraedrica, le linee rosse mostrano molecole di H2O di struttura disordinata. Le sfere grandi mostrano atomi di ossigeno, le palline mostrano l'idrogeno e le linee bianche tratteggiate rappresentano i legami idrogeno. Credito:2018 Hajime Tanaka, Istituto di Scienze Industriali, L'Università di Tokyo
Un gruppo di ricerca giapponese guidato dall'Università di Tokyo ha studiato la transizione dell'acqua da fragile a forte. A differenza della maggior parte dei liquidi, quando l'acqua si è raffreddata, il tasso di aumento della sua viscosità raggiunge un massimo ad una certa bassa temperatura. Il team ha dimostrato che la modellazione dell'acqua come una miscela di due stati dipendente dalla temperatura (acqua veloce disordinata e acqua lenta ordinata localmente) ha spiegato la transizione da fragile a forte ed ha evitato le previsioni errate delle teorie precedenti basate sul comportamento vetroso.
L'acqua è strana in molti modi. Alcune delle sue stranezze chimiche sono familiari, come l'espansione quando si congela in ghiaccio. Una curiosità meno nota, che condivide con pochi altri liquidi, è la transizione da fragile a forte. Spiegando questo comportamento, che si riferisce a come scorre l'acqua fredda, è stata a lungo fonte di dibattito. Ora, una spiegazione convincente è stata avanzata dai ricercatori di Tokyo.
Quando i liquidi si raffreddano, le loro dinamiche rallentano e diventano vischiose. Per la maggior parte dei liquidi, la velocità di rallentamento è costante in funzione della temperatura e questi sono conosciuti come liquidi forti. Per liquidi fragili, però, la velocità aumenta continuamente al diminuire della temperatura. L'acqua è insolita in questo senso:è fragile a temperatura ambiente, ma forte alle basse temperature, dove il suo tasso di viscosità crescente raggiunge un picco.
Questa transizione da fragile a forte è sfuggente, che si verifica solo nel regime superraffreddato, al di sotto del normale punto di congelamento dell'acqua. I primi modelli hanno cercato di collegarlo a dinamiche vetrose, poiché l'acqua superraffreddata è nota per essere un formatore di vetro. Però, un team guidato dall'Istituto di scienze industriali (IIS) dell'Università di Tokyo propone una teoria a due stati, in effetti modellando l'acqua come una miscela di due liquidi coesistenti.
Matematicamente, la distinzione forte/fragile si basa sulla legge di Arrhenius per i processi dinamici:i liquidi forti obbediscono a questa legge, ma per quelli fragili, il rapido aumento della viscosità è super-Arrhenius. Come riportato sulla rivista PNAS , il team dell'IIS ha modificato questo punto di vista considerando che l'acqua consiste di due stati, definito "veloce" e "lento, "che sono strutturalmente differenti, ma entrambi obbediscono alla dinamica di Arrhenius.
"Abbiamo simulato l'acqua mediante la dinamica molecolare e cercato modelli strutturali, " spiega il coautore dello studio Rui Shi. "Le molecole di H2O si assemblano sempre in tetraedri, ma abbiamo visto che alcune di queste strutture locali erano molto ordinate, altri meno." Gli stati disordinati corrispondono all'acqua veloce, e dominare ad alta temperatura, mentre lo stato lento ben ordinato prende il sopravvento mentre il campione si raffredda.
In modo cruciale, le equazioni derivate dal modello a due stati prevedono con successo il crossover fragile-forte. Questo accade ben al di sopra del punto di transizione vetrosa:il comportamento vetroso sembra essere un'aringa rossa per quanto riguarda questo problema. Il fatto che l'acqua veloce abbia Arrhenius, piuttosto che legge di potere, Dynamics risolve anche previsioni errate basate su precedenti tentativi di collegare la fragilità dell'acqua ad alcuni aspetti del suo diagramma di fase.
"L'acqua fragile può essere un'illusione. L'apparente transizione è un artefatto dell'equilibrio dipendente dalla temperatura di due forti stati liquidi, ", afferma l'autore principale Hajime Tanaka. "La presenza di due stati riflette la tendenza dell'acqua a formare strutture locali, che è più facile a bassa temperatura. Infatti, altri liquidi con una transizione da fragile a forte, come la silice, mostra anche l'ordinamento locale. Proponiamo che questo, piuttosto che qualsiasi comportamento vitreo, è ciò che li distingue dai veri liquidi fragili."