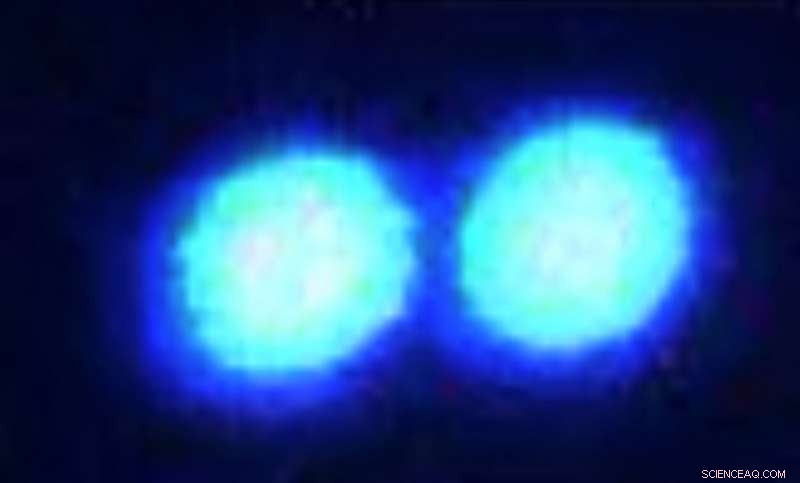
Goccioline micron di fusione nel sarcoma, una proteina disordinata legata alla SLA, sono visualizzati attraverso un microscopio confocale a fluorescenza. Credito:Priya Banerjee Lab presso UB
I fisici dell'Università di Buffalo stanno utilizzando strumenti innovativi per studiare le proprietà di una bizzarra classe di molecole che possono svolgere un ruolo nella malattia:proteine che si raggruppano per formare goccioline sferiche all'interno delle cellule umane.
L'ultima ricerca degli scienziati fa luce sulle condizioni che spingono tali goccioline a passare da un fluido, stato liquido a uno stato più duro, stato gelatinoso.
Pubblicato il 19 febbraio sulla rivista Biomolecole come articolo in evidenza, lo studio rileva che alcune goccioline proteiche si induriscono, diventare gelatinosa in ambienti affollati (come provette dove sono presenti molte altre molecole, imitando le condizioni congestionate all'interno delle cellule viventi).
"Queste proteine che formano goccioline sono un'area di studio relativamente nuova, quindi sappiamo molto poco delle loro proprietà di base, " dice l'investigatore capo Priya R. Banerjee, dottorato di ricerca, assistente professore di fisica presso l'UB College of Arts and Sciences. "Come fisici, vogliamo quantificare la dinamica di queste goccioline e apprendere quali fattori le influenzano. Questo è importante in quanto le dinamiche delle goccioline proteiche sono una chiave per la loro funzione e disfunzione cellulare.
"La ricerca precedente si è concentrata sulla struttura delle proteine stesse, ma il nostro lavoro mostra che i fattori ambientali sono ugualmente importanti. Vediamo che le condizioni esterne possono alterare lo stato interno delle goccioline, che possono influenzare la loro funzione nelle cellule umane."
La ricerca è importante perché le proteine di condensazione possono essere coinvolte nella salute e nella malattia. Studi recenti indicano ruoli potenziali per queste goccioline in funzioni così diverse come l'espressione genica, risposta allo stress e funzione del sistema immunitario.
Il nuovo articolo indaga su una proteina che forma goccioline chiamata fusa nel sarcoma (FUS). Le goccioline liquide FUS si trovano nelle cellule cerebrali normali, ma in alcuni pazienti con la malattia neurodegenerativa sclerosi laterale amiotrofica (SLA), la proteina forma aggregati di materiale solido, Banerjee dice. Non è chiaro perché.
Utilizzo dei laser per pizzicare e colpire le goccioline di proteine
La ricerca ha impiegato due tecniche innovative per mostrare come le condizioni ambientali possono influenzare le goccioline prodotte da FUS o altre proteine correlate.
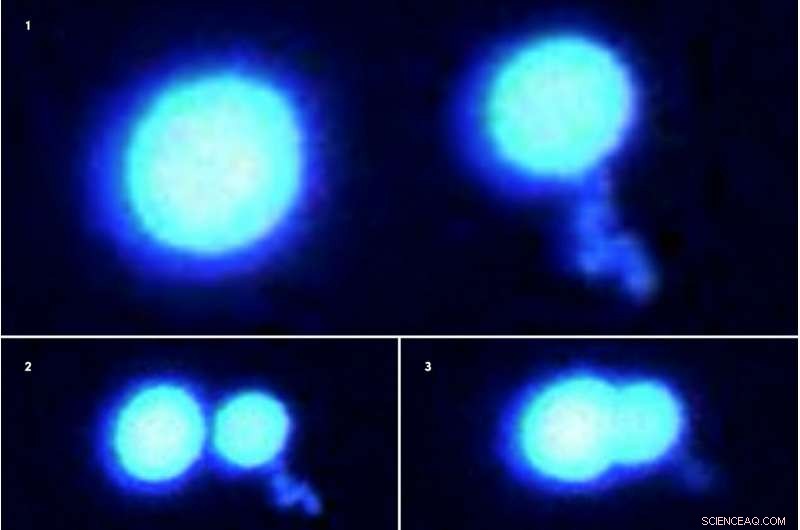
Due goccioline proteiche si rifiutano di fondersi quando vengono messe insieme (immagini al microscopio a fluorescenza 1-3, mostrato in sequenza). Le goccioline, a base di proteine fuse in sarcoma, sono in difficoltà, stato gelatinoso mentre siedono in una soluzione affollata di altre molecole. Gli scienziati hanno utilizzato una tecnologia di tweezing ottica all'avanguardia per afferrare e manipolare queste microgoccioline proteiche. Credito:Priya Banerjee Lab presso UB
In una serie di esperimenti, gli scienziati hanno utilizzato raggi laser altamente focalizzati, chiamati pinzette ottiche, per intrappolare e spingere insieme due goccioline di proteine che galleggiano in una soluzione tampone liquida.
Le goccioline proteiche si sono fuse facilmente per formare un'unica gocciolina più grande quando il tampone era popolato in modo sottile con altre molecole crowder inerti come il glicole polietilenico (PEG). Ma quando la concentrazione di PEG o di altre sostanze chimiche nel tampone aumenta, le goccioline proteiche diventavano più gelatinose e non si combinavano completamente.
In una seconda serie di prove, il team ha impiegato i laser in un modo diverso - "laser poke" - per studiare come il FUS e le relative goccioline proteiche reagiscono agli ambienti affollati.
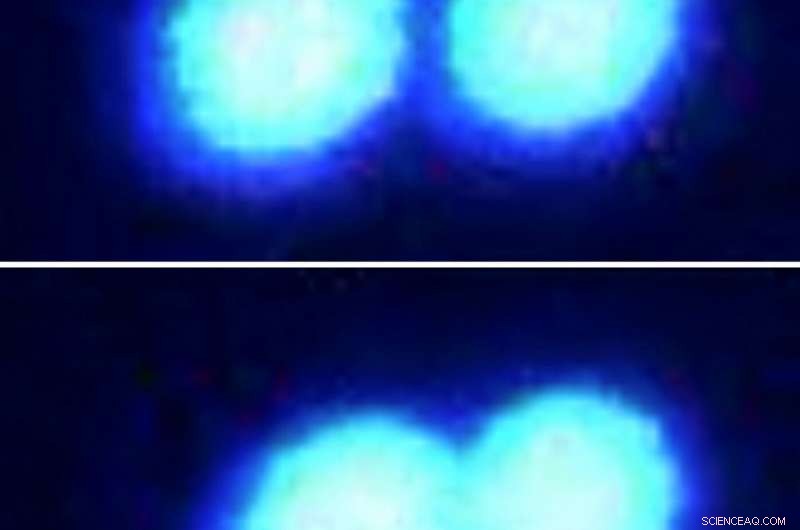
Due goccioline proteiche si fondono facilmente quando vengono spinte insieme (mostrate in sequenza nelle immagini al microscopio a fluorescenza, dall'alto verso il basso.) Le goccioline, a base di proteine fuse in sarcoma, hanno una consistenza fluida poiché si trovano in una soluzione scarsamente popolata da altre molecole. Gli scienziati hanno utilizzato una tecnologia di tweezing ottica all'avanguardia per afferrare e manipolare queste microgoccioline proteiche. Credito:Priya Banerjee Lab presso UB
In questi esperimenti, Banerjee e colleghi hanno attaccato tag fluorescenti a numerose molecole proteiche in una singola gocciolina, facendo brillare le proteine. I ricercatori hanno quindi "colpito" il centro della gocciolina con un laser ad alta intensità, una procedura che ha causato l'oscuramento permanente di qualsiasi molecola fluorescente colpita dal laser.
Prossimo, gli scienziati hanno misurato il tempo impiegato dalle nuove proteine luminose per spostarsi nell'area oscurata. Ciò è accaduto rapidamente nelle goccioline proteiche che galleggiano in soluzioni tampone scarsamente popolate. Ma il tempo di recupero è stato notevolmente più lento per le goccioline sospese in soluzioni tampone dense di PEG o altri composti:un'indicazione, di nuovo, che le goccioline proteiche diventano gelatinose in ambienti affollati. I risultati si sono applicati sia a FUS che ad altre goccioline proteiche correlate con diverse strutture primarie.
"I nostri esperimenti sono stati fatti in provette, ma i nostri risultati suggeriscono che all'interno delle cellule viventi, lo stato di affollamento potrebbe influenzare la dinamica delle goccioline proteiche, " dice Banerjee.
Una domanda importante che rimane è se e come la fluidità delle goccioline FUS influisce sulla capacità della proteina di formarsi in grumi solidi, come visto in alcuni pazienti con SLA. Banerjee spera di affrontare questo problema attraverso ricerche future.