Attestazione:UMONS
A seconda delle condizioni fisiologiche o patologiche in esame, le cellule possono migrare come fogli epiteliali grandi e coesivi. Mentre la maggior parte dei lavori precedenti suggerisce che i meccanismi migratori sono fortemente regolati da contatti intercellulari, l'impatto dei vincoli fisici sulla migrazione collettiva rimane poco chiaro.
Un recente studio condotto da Danahe Mohammed, un dottorato di ricerca studente al momento di questo studio, e il professor Sylvain Gabriele dell'Università di Mons in Belgio riferisce che il confinamento spaziale esercitato dalle cellule vicine modula la velocità di migrazione dei tessuti epiteliali. Questo lavoro è stato pubblicato nel numero di giugno 2019 di Fisica della natura .
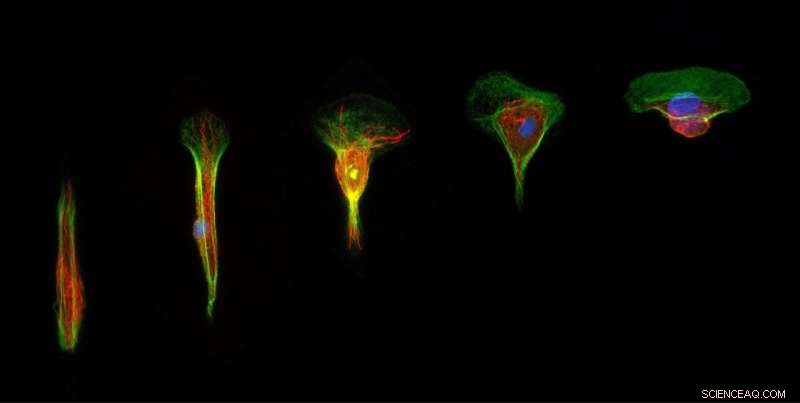
Il team di Gabriele ha riprodotto il confinamento fisiologico osservato nei tessuti viventi in modo molto controllato utilizzando tecniche di microfabbricazione per generare microstrisce adesive. Questi modelli in vitro consentono ai ricercatori di confinare le singole cellule epiteliali su piste adesive con larghezze variabili da cinque a 20 µm, senza creare adesioni intercellulari. Il team di ricerca ha utilizzato cellule epiteliali raccolte dalla scala dei ciclidi centroamericani Hypsophrys nicaraguensis come un solido modello primario di migrazione.
Riferiscono che le cellule che migrano in ambienti confinati rallentano e cambiano la loro morfologia tridimensionale, come osservato nei tessuti epiteliali densi. Il team di Gabriele ha rivelato che gli ambienti confinati riducono le forze protrusive esercitate sul fronte cellulare e impediscono la maturazione delle aderenze focali sul bordo d'uscita, insieme portando a forze di propulsione meno efficaci. Questi risultati dimostrano che il solo confinamento epiteliale può indurre comportamenti simili ai seguaci e identificare il confinamento dell'area adesiva del substrato come determinante chiave della velocità cellulare nella migrazione collettiva.
L'interfaccia tra fisica, la chimica di superficie e la biologia cellulare gettano ancora una volta luce su un meccanismo cellulare finora poco compreso e forniscono un meccanismo generico per l'interpretazione della migrazione collettiva.