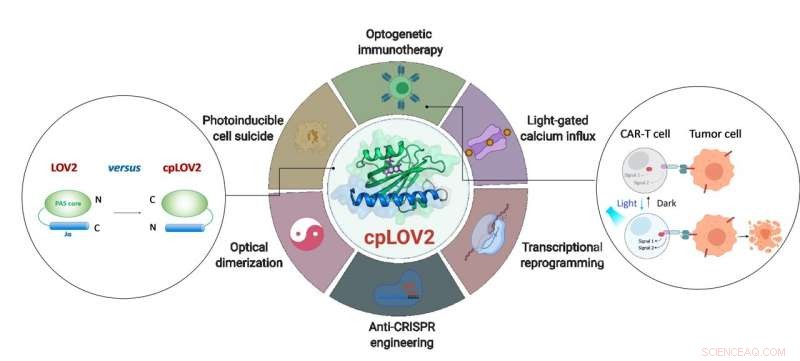
Il progetto di cpLOV2 e la sua applicazione estesa nell'ingegneria optogenetica. Credito:ZHU Lei
Recentemente, Prof. WANG Junfeng dell'High Magnetic Field Laboratory degli Hefei Institutes of Physical Science (HFIPS), insieme a studiosi internazionali, ha sviluppato un nuovo voltaggio luce-ossigeno permutato circolare 2 (LOV2) per espandere il repertorio di fotointerruttori codificati geneticamente, che accelererà la progettazione di nuovi dispositivi optogenetici. Il risultato è stato pubblicato in Natura chimica biologia .
Il dominio LOV2 è un fotointerruttore blu sensibile alla luce. In un tipico dispositivo optogenetico basato su LOV2, un dominio effettore è fuso dopo l'elica Jα C-terminale di LOV2, con l'intenzione di ingabbiare l'effettore tramite impedimento sterico al buio. Sulla fotostimolazione, lo spiegamento dell'elica Jα attivato dalla luce espone il dominio dell'effettore per ripristinare la sua funzione. La creazione di una proteina fotocommutabile basata su LOV2 spesso richiede enormi sforzi ingegneristici per ottimizzare ogni componente e il linker di collegamento in mezzo. Perciò, è auspicabile espandere l'attuale cassetta degli attrezzi optogenetica creando nuovi moduli che semplifichino questi passaggi.
In questo studio, i ricercatori hanno progettato cpLOV2 utilizzando la permutazione circolare, un solido approccio di ingegneria proteica precedentemente utilizzato per sviluppare nuove varianti di sonde fluorescenti e biocatalizzatori geneticamente codificati. I terminali di azoto (N) e carbonio (C) di cpLOV2 sono stati creati al N-terminale dell'elica Jα mentre quelli vecchi erano collegati da un linker ricco di glicina e serina. Perciò, l'effettore potrebbe essere fuso prima dell'N-terminale Jα di cpLOV2 oltre al C-terminale in LOV2.
Utilizzando la spettroscopia NMR ad alta risoluzione e altre tecniche, i ricercatori hanno dimostrato che l'integrità strutturale e la funzione della dissociazione Jα indotta dalla luce di cpLOV2 sono ben mantenute. cpLOV2 ha funzionato bene anche in LOVRAP e ha migliorato il dimero indotto dalla luce (iLid), entrambi sono sistemi di eterodimerizzazione ottica basati su LOV2.
cpLOV2 ha fornito più scelte per gli sviluppi di applicazioni optogenetiche. I ricercatori hanno generato una serie di ibridi fondendo LOV2 o cpLOV2 con diversi Ca 2+ frammenti di attivazione del canale e autoinibizione derivati dalla molecola di interazione stromale 1, e ha trovato diversi nuovi attuatori ottici basati su cpLOV2 per gate ORAI1 Ca 2+ canale, quindi hanno dimostrato che cpLOV2 potrebbe offrire nuove superfici di ingabbiamento per superare i limiti associati a LOV2 di tipo selvatico.
Poiché gli effettori richiedevano un terminale N libero per eseguire la sua piena funzione, cpLOV2 è una scelta migliore. Una proteina chiave coinvolta nella necroptosi, proteina mista lignaggio chinasi dominio-simile (MLKL), è stato il successo ingabbiato e non ingabbiato in cpLOV2-MLKL ma non in MLKL-LOV2 per il controllo ottico dei suicidi cellulari.
La terapia con cellule T del recettore dell'antigene chimerico (CAR) è emersa come un promettente approccio immunoterapeutico. Però, l'attività incontrollabile delle cellule CAR T durante la terapia causerebbe gravi effetti collaterali, ad es. sindrome da rilascio di citochine in alcuni pazienti. I ricercatori hanno progettato sistemi di eterodimerizzazione ottica basati su cpLOV2 (cpLID), e costruito auto split foto-sintonizzabile (optoCAR). Le cellule T optoCAR terapeutiche possono essere specificamente attivate dall'antigene tumorale CD19 e dalla luce blu, e poi proliferano per uccidere CD19 + Cellule di linfoma Raji.
Nel modello murino impiantato con CD19 + cellule Raji, i ricercatori hanno utilizzato le nanoparticelle di conversione (UCNP) per convertire la luce nel vicino infrarosso ad alta penetrazione tissutale in luce blu e attivare le cellule T optoCAR iniettate e ottenere una terapia altamente efficace del tumore del linfoma. Le cellule T OptoCAR sviluppate in questo studio consentono il controllo spazio-temporale e reversibile delle attività delle cellule T e della produzione di citochine.
Questi risultati incoraggianti suggeriscono che le cellule T optoCAR potrebbero mitigare i potenziali effetti collaterali senza perdere l'efficacia terapeutica. Nel futuro, hanno in programma di provare l'immunoterapia optogenetica per trattare diversi tipi di cancro.