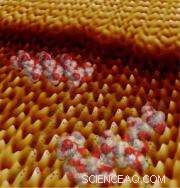
Modelli di peptidi e della struttura cristallina dell'ossalato di calcio monoidrato su un'immagine al microscopio a forza atomica raccolta durante la crescita dei cristalli. Il bordo inferiore di questa immagine è di circa 60 atomi di diametro. (Immagine per gentile concessione di Jim DeYoreo, et. al)
(PhysOrg.com) -- Gli scienziati della Molecular Foundry di Berkeley Lab hanno ripreso la crescita di superfici minerali tempestate di proteine con una risoluzione senza precedenti e hanno fornito uno sguardo su come i sistemi viventi progettano i materiali strutturali chiave.
Gli scienziati della Molecular Foundry del Lawrence Berkeley National Laboratory hanno ripreso la crescita di superfici minerali tempestate di proteine con una risoluzione senza precedenti, fornendo uno sguardo ai materiali strutturali chiave progettati da sistemi viventi. La tecnica ad alta risoluzione del team rivela i meccanismi naturali impiegati dalle creature sia in mare che a terra, e potrebbe fornire un mezzo per osservare e guidare questa crescita dei cristalli mentre si verifica.
Per milioni di anni, organismi dalle alghe agli esseri umani hanno utilizzato la biomineralizzazione, il processo di organizzazione di minerali come il carbonato di calcio in sistemi biologici, per generare conchiglie, spine, ossa e altri materiali strutturali. Recentemente, i ricercatori hanno iniziato a svelare la struttura e la composizione di questi biominerali. Però, capire come le biomolecole interagiscono con i minerali per formare queste complesse architetture rimane una sfida formidabile, poiché richiede una risoluzione a livello molecolare e capacità di imaging rapido che non disturbano o alterano l'ambiente locale.
Video:il filmato di microscopia a forza atomica mostra un peptide adsorbito su una superficie di cristallo mentre interagiscono due fasi successive di cristallo, quindi progredire oltre il peptide. Il peptide rallenta temporaneamente il passaggio prima di trasferirsi allo strato atomico successivo. Il reticolo sulla superficie corrisponde alla struttura molecolare del cristallo sottostante.
Microscopia a forza atomica, che traccia colline e valli su scala nanometrica attraverso il terreno di un cristallo con una sonda affilata, viene spesso utilizzato per studiare le superfici. Le deviazioni che una sonda incontra attraverso un materiale vengono tradotte in segnali elettrici, quindi utilizzati per creare un'immagine della superficie. Però, è necessaria un'attenta azione di bilanciamento per mantenere la risoluzione fornita da una sonda affilata e la flessibilità necessaria per lasciare imperturbate le molecole biologiche morbide. Ora, I ricercatori di Molecular Foundry hanno sviluppato uno strumento in grado di discernere materiali biologici delicati e minuscole ondulazioni sulla superficie di un cristallo, il tutto mentre osservano il processo di mineralizzazione in presenza di proteine.
“Abbiamo trovato un approccio per visualizzare in modo coerente macromolecole morbide su una superficie di cristallo duro con risoluzione molecolare, e lo abbiamo fatto in soluzione e a temperatura ambiente, che è molto più applicabile agli ambienti naturali, "dice Jim De Yoreo, vicedirettore della Fonderia Molecolare, una struttura nazionale per gli utenti del Dipartimento dell'energia degli Stati Uniti situata presso il Berkeley Lab che fornisce supporto ai ricercatori di nanoscienze di tutto il mondo.
“Con queste sonde ibride, possiamo letteralmente osservare le biomolecole interagire con una superficie di cristallo mentre il cristallo cresce un passo atomico alla volta. Nessuno è stato in grado di seguire questo processo con questo tipo di risoluzione fino ad ora, "dice Raymond Friddle, uno studioso post-dottorato presso il Lawrence Berkeley National Laboratory.
De Yoreo, Frigo, co-autori Matt Weaver e Roger Qiu (Lawrence Livermore National Laboratory), Bill Casey (Università della California, Davis) e Andrzej Wierzbicki (Università dell'Alabama meridionale), ha usato queste sonde per microscopio a forza atomica "ibride" per studiare le interazioni tra un cristallo in crescita di ossalato di calcio monoidrato, un minerale presente nei calcoli renali umani, e peptidi, molecole polimeriche che svolgono funzioni metaboliche nelle cellule viventi. Queste sonde ibride combinano nitidezza e flessibilità, che è cruciale per raggiungere la velocità e la risoluzione necessarie per monitorare il cristallo in crescita con il minimo disturbo ai peptidi.
I risultati del team rivelano un processo complesso. Su una sfaccettatura caricata positivamente di ossalato di calcio monoidrato, i peptidi formano un film che agisce come un interruttore per attivare o disattivare la crescita dei cristalli. Però, su una sfaccettatura carica negativamente, i peptidi si urtano insieme sulla superficie per creare cluster che rallentano o accelerano la crescita dei cristalli.
“I nostri risultati mostrano che gli effetti dei peptidi su un cristallo in crescita sono molto più complicati rispetto a quelli più semplici, piccole molecole. Le forme dei peptidi in soluzione tendono a fluttuare, e a seconda delle condizioni, i complessi processi attraverso i quali i peptidi si attaccano alle superfici consentono loro di controllare la crescita dei cristalli come una serie di "interruttori, manette e freni', "dice Frida. “Possono rallentare o accelerare la crescita, o anche commutarlo bruscamente da on a off con piccoli cambiamenti nelle condizioni della soluzione.”
Il team prevede di utilizzare il nuovo approccio per studiare la fisica fondamentale delle superfici cristalline nelle soluzioni e approfondire la comprensione di come interagiscono biomolecole e cristalli. “Riteniamo che questi risultati getteranno le basi per un migliore controllo sui cristalli tecnologici, approcci biomimetici alla sintesi dei materiali, e potenziali terapie per patologie dei tessuti duri, ” aggiunge DeYoreo.