
Immagine AFM (microscopia a forza atomica) di nanoparticelle d'argento formate da ioni d'argento in soluzione con acido umico. Il tono di colore in questa immagine indica l'altezza (da 0 a 10 nanometri) sopra il piano di base, così i punti più luminosi sono più alti, nanoparticelle più grandi. L'immagine è circa 1, 700 nm per lato. Attestazione:MacCuspie, NIST
Le nanoparticelle di argento si trovano sempre più nell'ambiente e nei laboratori di scienze ambientali. Poiché hanno una varietà di proprietà utili, soprattutto come agenti antibatterici e antimicotici, le nanoparticelle d'argento sono sempre più utilizzate in un'ampia varietà di prodotti industriali e di consumo. Questo, a sua volta, ha sollevato preoccupazioni su ciò che accade loro una volta rilasciati nell'ambiente. Ora un nuovo documento di ricerca aggiunge un'ulteriore ruga:la natura potrebbe produrre da sola nanoparticelle d'argento.
Un team di ricercatori del Florida Institute of Technology (FIT), l'Università statale di New York (SUNY), bufalo, e il National Institute of Standards and Technology (NIST) riferisce che, data una fonte di ioni d'argento, l'acido umico naturale sintetizzerà nanoparticelle d'argento stabili.
“Il nostro collega, Virender Sharma, aveva letto un articolo in cui usavano il vino per formare nanoparticelle. Ha pensato che, sulla base della chimica simile, dovremmo essere in grado di produrre nanoparticelle d'argento con acidi umici, ” spiega la chimica FIT Mary Sohn. “Prima li abbiamo formati con metodi tradizionali e poi abbiamo provato uno dei nostri acidi umici di sedimenti fluviali. Eravamo davvero entusiasti di poter vedere il caratteristico colore giallo delle nanoparticelle”. I campioni sono stati inviati a Sarbajit Banerjee della SUNY Buffalo ea Robert MacCuspie del NIST per analisi dettagliate per confermare la presenza di nanoparticelle d'argento.
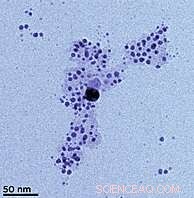
Immagine al microscopio elettronico a trasmissione (TEM) di nanoparticelle d'argento formate da ioni d'argento in soluzione con acido umico. L'acido tende a rivestire le nanoparticelle (visibili qui come una nuvola pallida), tenendoli in una sospensione colloidale invece di aggregarsi. (Colore aggiunto per chiarezza.)Credito:SUNY, bufalo
L'"acido umico" è una miscela complessa di molti acidi organici che si formano durante il decadimento della materia organica morta. Sebbene la composizione esatta vari da luogo a luogo e da stagione a stagione, l'acido umico è ubiquitario nell'ambiente. nanoparticelle metalliche, MacCuspie spiega, hanno colori caratteristici che sono una diretta conseguenza delle loro dimensioni. Le nanoparticelle d'argento appaiono di un marrone giallastro.
Il team ha miscelato ioni d'argento con acido umico da una varietà di fonti a diverse temperature e concentrazioni e ha scoperto che gli acidi dell'acqua del fiume o dei sedimenti formerebbero nanoparticelle d'argento rilevabili a temperatura ambiente in appena due o quattro giorni. Inoltre, MacCuspie dice, l'acido umico sembra stabilizzare le nanoparticelle rivestendole e impedendo alle nanoparticelle di aggregarsi in una massa d'argento più grande. “Crediamo che sia in realtà un processo simile a come le nanoparticelle vengono sintetizzate in laboratorio, "dice, tranne per il fatto che il processo di laboratorio utilizza tipicamente acido citrico a temperature elevate.
"Questo ci ha colto di sorpresa perché gran parte del nostro lavoro si concentra su come le nanoparticelle d'argento possono dissolversi quando vengono rilasciate nell'ambiente e rilasciano ioni d'argento, "dice MacCuspie. Molti biologi ritengono che la tossicità delle nanoparticelle d'argento, il motivo del loro uso come agente antibatterico o antimicotico, è dovuto alla loro elevata superficie che li rende una fonte efficiente di ioni d'argento, lui dice, ma "questo crea l'idea che potrebbe esserci una sorta di ciclo naturale che restituisce alcuni degli ioni alle nanoparticelle". negli ultimi anni, di nanoparticelle d'argento in luoghi come le vecchie regioni minerarie che probabilmente non sono state esposte a nanoparticelle artificiali, ma avrebbe concentrazioni significative di ioni d'argento.