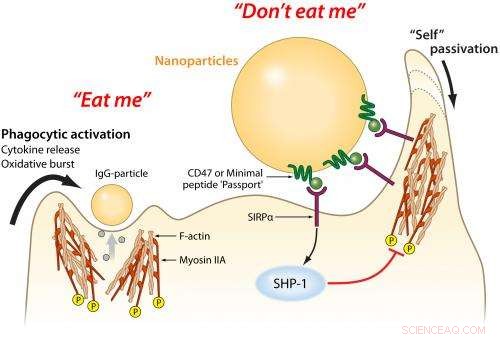
I macrofagi sono "guardie di frontiera" delle cellule immunitarie che si sono evolute per mangiare tutti i tipi di microbi estranei, ma mangiano anche molte particelle destinate alla terapia e all'imaging. Un "passaporto" di peptide minimo attaccato alle particelle fornisce segnali di riconoscimento in modo che le particelle non vengano mangiate, migliorando così la consegna alle cellule malate del corpo. Credito:Mary Leonard, Arte e design biomedico, Università della Pennsylvania
Il sistema immunitario del corpo esiste per identificare e distruggere oggetti estranei, se sono batteri, virus, macchie di sporco o schegge. Sfortunatamente, nanoparticelle progettate per rilasciare farmaci, e dispositivi impiantati come pacemaker o articolazioni artificiali, sono altrettanto estranei e soggetti alla stessa risposta.
Ora, i ricercatori della University of Pennsylvania School of Engineering and Applied Science e del Penn's Institute for Translational Medicine and Therapeutics hanno trovato un modo per fornire un "passaporto" per tali dispositivi terapeutici, consentendo loro di superare il sistema di sicurezza del corpo.
La ricerca è stata condotta dal professor Dennis Discher, studenti laureati Pia Rodriguez, Takamasa Harada, David Christian e Richard K. Tsai e il borsista post-dottorato Diego Pantano del Molecular and Cell Biophysics Lab in Chemical and Biomolecular Engineering at Penn.
È stato pubblicato sulla rivista Scienza .
"Dal punto di vista del tuo corpo, " ha detto Rodriguez "una punta di freccia mille anni fa e un pacemaker oggi sono trattati allo stesso modo, come un invasore straniero.
"Ci piacerebbe molto cose come pacemaker, suture e veicoli di somministrazione di farmaci per non causare una risposta infiammatoria dal sistema immunitario innato".
Il sistema immunitario innato attacca i corpi estranei in modo generale. A differenza della risposta appresa del sistema immunitario adattativo, che include gli anticorpi mirati che si formano dopo una vaccinazione, il sistema immunitario innato cerca di distruggere tutto ciò che non riconosce come parte del corpo.
Questa risposta ha molti componenti cellulari, compresi i macrofagi - letteralmente "grandi mangiatori" - che trovano, inghiottire e distruggere gli invasori. Le proteine nel siero del sangue lavorano in tandem con i macrofagi; aderiscono agli oggetti nel flusso sanguigno e attirano l'attenzione dei macrofagi. Se il macrofago determina che queste proteine sono attaccate a un invasore estraneo, lo mangeranno o segnaleranno ad altri macrofagi di formare una barriera attorno ad esso.
Le nanoparticelle di rilascio di farmaci attivano naturalmente questa risposta, quindi i precedenti tentativi dei ricercatori di eluderlo prevedevano il rivestimento delle particelle con "spazzole" polimeriche. Questi pennelli sporgono dalla nanoparticella e tentano di bloccare fisicamente varie proteine del siero del sangue dall'attaccarsi alla sua superficie.
Però, questi pennelli rallentano solo le proteine di segnalazione dei macrofagi, così Discher e colleghi hanno provato un approccio diverso:convincere i macrofagi che le nanoparticelle facevano parte del corpo e non dovevano essere eliminate.
Nel 2008, Il gruppo di Discher ha mostrato che la proteina umana CD47, presente su quasi tutte le membrane cellulari dei mammiferi, si lega a un recettore dei macrofagi noto come SIRPa nell'uomo. Come una guardia di frontiera di pattuglia che ispeziona un passaporto, se il SIRPa di un macrofago si lega al CD47 di una cellula, dice al macrofago che la cellula non è un invasore e dovrebbe poter continuare.
"Potrebbero esserci altre molecole che aiutano a sedare la risposta dei macrofagi, " Discher ha detto. "Ma il CD47 umano è chiaramente uno che dice, 'Non mangiarmi'."
Dalla pubblicazione di tale studio, altri ricercatori hanno determinato insieme la struttura combinata di CD47 e SIRPa. Utilizzando queste informazioni, Il gruppo di Discher è stato in grado di progettare computazionalmente la più piccola sequenza di amminoacidi che agisse come CD47. Questo "peptide minimo" dovrebbe piegarsi e adattarsi abbastanza bene al recettore di SIRPa per fungere da passaporto valido.
Dopo aver sintetizzato chimicamente questo peptide minimo, Il team di Discher lo ha collegato a nanoparticelle convenzionali che potrebbero essere utilizzate in una varietà di esperimenti.
"Ora, chiunque può fare il peptide e metterlo su quello che vuole, " ha detto Rodriguez
Gli esperimenti del team di ricerca hanno utilizzato un modello murino per dimostrare una migliore rappresentazione dei tumori e una migliore efficacia di una particella di rilascio di farmaci antitumorali.
Poiché questo peptide minimo potrebbe un giorno essere attaccato a un'ampia gamma di veicoli per la somministrazione di farmaci, i ricercatori hanno anche attaccato anticorpi del tipo che potrebbero essere utilizzati per colpire le cellule tumorali o altri tipi di tessuto malato. Al di là di una prova di concetto per le terapie, questi anticorpi servivano anche ad attirare l'attenzione dei macrofagi e ad assicurare che il passaporto del peptide minimo fosse controllato e approvato.
"Stiamo dimostrando che il peptide in realtà inibisce la risposta del macrofago, " Discher ha detto. "Forziamo l'interazione e poi la travolgiamo".
Il test dell'efficacia di questo peptide minimo è stato effettuato su topi geneticamente modificati in modo che i loro macofagi avessero recettori SIRPa simili a quelli umani. I ricercatori hanno iniettato due tipi di nanoparticelle, quelle con il passaporto peptidico e quelle senza, e poi hanno misurato la velocità con cui il sistema immunitario dei topi le ha eliminate.
"Abbiamo usato diversi coloranti fluorescenti sui due tipi di nanoparticelle, in modo da poter prelevare campioni di sangue ogni 10 minuti e misurare quante particelle di ogni tipo sono rimaste utilizzando la citometria a flusso, " ha detto Rodriguez. "Abbiamo iniettato le due particelle in un rapporto 1 a 1 e 20-30 minuti dopo, c'erano fino a quattro volte più particelle con il peptide rimasto".
Anche dare alle nanoparticelle terapeutiche una mezz'ora in più prima che vengano mangiate dai macrofagi potrebbe essere un grande vantaggio per i trattamenti. Tali nanoparticelle potrebbero aver bisogno di fare alcuni viaggi attraverso la milza e il fegato, ricchi di macrofagi, per trovare i loro bersagli, ma non dovrebbero rimanere nel corpo a tempo indeterminato. Altre combinazioni di proteine esterne potrebbero essere appropriate per dispositivi più permanenti, come gli elettrocateteri del pacemaker, consentendo loro di nascondersi dal sistema immunitario per periodi di tempo più lunghi.
Sebbene siano necessarie ulteriori ricerche prima che tali applicazioni diventino realtà, ridurre il peptide a una sequenza di pochi amminoacidi è stato un passaggio critico. La relativa semplicità di questa molecola passaporto per essere più facilmente sintetizzata lo rende un componente più attraente per le future terapie.
"Può essere fatto in modo pulito in una macchina, "Discher ha detto, "e facilmente modificabile durante la sintesi per attaccarsi a tutti i tipi di cose impiantate e iniettate, con l'obiettivo di ingannare il corpo nell'accettare queste cose come 'sé'".