Credito:ACS
(Phys.org) —Ricercatori tedeschi hanno sviluppato uno schema per la preparazione di nanoparticelle che offre un sistema altamente versatile per la somministrazione mirata di farmaci direttamente in diversi tipi di cellule tumorali.
Le nanoparticelle hanno dimensioni di pochi milionesimi di millimetro, e sono quindi abbastanza piccoli da conquistare le cellule. Questa proprietà apre nuove opportunità nella lotta contro il cancro, che sono attualmente oggetto di un'intensa attività di ricerca. Un team LMU guidato dal professor Christoph Bräuchle e dal professor Thomas Bein ha ora sviluppato una piattaforma altamente adattabile per la produzione di nanoparticelle che possono essere utilizzate come "nanoferry" per la somministrazione mirata di una gamma di carichi di farmaci a vari tipi di cellule cancerose. Il sistema è descritto in un articolo appena apparso sulla rivista Nano lettere .
Soprattutto, il nuovo approccio consente di fabbricare nanoparticelle progettate su misura per compiti particolari. "Le particelle possono essere facilmente caricate con una varietà di agenti chimici e dotate di etichette riconosciute da specifici tipi di cellule. Pertanto, si legano specificamente a determinate cellule tumorali e rilasciano il loro carico solo dopo l'assorbimento da parte della cellula, "dice Christoph Bräuchle che, come il suo collaboratore Thomas Bein, è membro della Nanosystems Initiative Munich (NIM), un Cluster di Eccellenza. Il sistema fornisce quindi un mezzo per trasportare farmaci antitumorali direttamente e specificamente nelle cellule tumorali.
L'uso di tali nanoparticelle come veicoli di consegna assicura che il loro carico eserciti il suo effetto solo all'interno delle cellule mirate. I composti utilizzati nella chemioterapia antitumorale sono spesso altamente tossici per molti tipi di cellule, quindi il targeting è fondamentale se si vuole ridurre al minimo i danni collaterali alle cellule sane astanti. Un targeting efficiente riduce quindi significativamente il rischio di gravi effetti collaterali, consentendo nel contempo di ridurre la dose necessaria per una risposta clinica significativa.
Sistemi di trasporto intelligenti
Le nanoparticelle intelligenti in grado di fornire farmaci mirati devono soddisfare una serie di criteri. Devono avere un'elevata capacità di carico, e hanno bisogno di un involucro compatibile con le membrane biologiche e in grado di presentare ligandi che si legano a recettori specifici sulle cellule bersaglio. Una volta che le particelle sono entrate nella cellula, devono essere stimolati da una sorta di segnale per rilasciare il loro carico chimico. "È estremamente difficile progettare una particella che soddisfi tutti questi criteri contemporaneamente. Ma ora abbiamo sviluppato un sistema che, in linea di principio, raggiunge questo obiettivo, e fornisce una piattaforma generalmente applicabile che è compatibile con diversi carichi e celle bersaglio, "dice Thomas Bein.
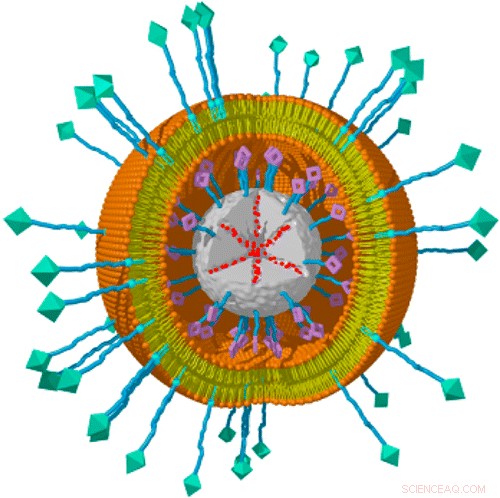
Il sistema è basato su nanoparticelle di biossido di silicio mesoporoso, che può essere biodegradato in modo sicuro e i cui pori offrono un ampio volume di stoccaggio per il carico. Un fotosensibilizzatore è attaccato alla superficie della particella, e il carico di droga viene caricato nei pori. Ogni particella è quindi racchiusa in un doppio strato lipidico simile alla membrana plasmatica di una tipica cellula. Un ligando riconosciuto dai recettori presenti su specifici tipi di cellule cancerose viene quindi inserito nel doppio strato. Nel nuovo lavoro, il team ha testato ligandi specifici per l'epatoma o le cellule del cancro cervicale. L'attivazione del fotosensibilizzatore con luce rossa porta a una rottura dell'involucro lipidico e quindi a un rilascio di carico.
"Che il fotosensibilizzatore risponde al rosso piuttosto che alla luce blu usata negli esperimenti precedenti, è un progresso importante. La luce rossa è meno tossica per le cellule e penetra più in profondità nei tessuti, "dice Veronika Weiss, il cui contributo allo studio farà parte della sua tesi di dottorato. La sua collega Alexandra Schmidt aggiunge:"Un altro punto critico è che il fotosensibilizzante è legato direttamente al vettore del farmaco, in modo che i suoi effetti siano localizzati nelle immediate vicinanze della nanoparticella stessa, e non hanno un impatto distruttivo su regioni più ampie dell'interno della cellula".
Il nuovo studio rappresenta un ulteriore passo avanti per una partnership a lungo termine di grande successo. Nel 2010, la stessa collaborazione ha sviluppato il metodo di base per innescare il rilascio di carico dalle nanoparticelle dopo il loro assorbimento da parte delle cellule bersaglio.