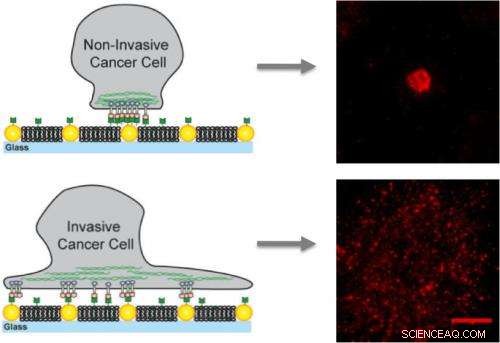
Su membrane artificiali incorporate con nanopunti d'oro, le cellule tumorali non invasive si legano solo ai nanopunti e vengono immobilizzate mentre le cellule invasive si legano alla membrana e ai nanopunti creando cluster mobili che contribuiscono alla metastasi.
(Phys.org) — Stanno crescendo le prove che lo sviluppo e la diffusione del cancro, a lungo attribuito all'espressione genica e alla segnalazione chimica andati storto, coinvolge anche una componente biomeccanica. I ricercatori del Lawrence Berkeley National Laboratory (Berkeley Lab) hanno aggiunto a questo corpo di prove dimostrando che l'attività maligna di un sistema proteico cellulare critico può derivare da quelli che essenzialmente sono gli ingorghi proteici.
Utilizzando un'esclusiva membrana artificiale imbevuta di un percorso a ostacoli di nanopunti d'oro, un team di ricerca guidato dal chimico Jay Groves ha studiato il trasporto del complesso di segnalazione proteica EphA2/ephrin-A1 attraverso le superfici di 10 diverse linee cellulari di cancro epiteliale del seno che mostrano un'ampia gamma di caratteristiche della malattia. I ricercatori hanno scoperto che il trasporto di questo complesso recettore-ligando era normale nelle linee cellulari più sane, ma si inceppava nelle linee cellulari malate, con il peggior inceppamento che si verificava nelle cellule più malate.
"C'è qualcosa su quanto fortemente le proteine EphA2 siano raggruppate insieme sulla superficie cellulare che è correlato e può persino contribuire al comportamento maligno delle cellule tumorali, "Dice Groves. "L'inceppamento differenziale del trasporto di EphA2 tra le varie linee cellulari di cancro al seno e la sua correlazione con le caratteristiche della malattia suggerisce che il clustering di EphA2 stesso può contribuire agli effetti patologici".
Groves tiene appuntamenti congiunti con la divisione di bioscienze fisiche del Berkeley Lab e il dipartimento di chimica dell'UC Berkeley, ed è anche un investigatore dell'Howard Hughes Medical Institute (HHMI). È l'autore corrispondente di un articolo che descrive questa ricerca sulla rivista Nano lettere intitolato "Gli array di ostacoli su nanoscala frustrano il trasporto di cluster EphA2/ephrin-A1 in linee cellulari cancerose". I coautori di questo articolo erano Theobald Lohmuller e Qian Xu.
EphA2 appartiene a una famiglia di enzimi che sono regolatori chiave dei processi cellulari. Ephrin-A1 è una proteina di segnalazione che si lega a EphA2. I complessi di EphA2/ephrin-A1 si riuniranno in cluster che verranno poi trasportati attraverso la superficie cellulare. La sovraespressione di EphA2 è stata collegata a una serie di tumori umani, ma è particolarmente importante nel cancro al seno.
"Circa il 40% di tutti i pazienti con cancro al seno mostra una sovraespressione di EphA2 che è correlata con metastasi tumorali, di conseguenza, molti sforzi sono stati indirizzati allo sviluppo di terapie mirate all'EphA2, "Dice Groves. "Tuttavia, esattamente ciò che va storto con l'EphA2 che contribuisce al comportamento patologico delle cellule rimane poco chiaro poiché l'EphA2 di solito non è mutato nelle cellule cancerose".
Groves è un'autorità leader nel campo emergente della meccanobiologia, che cerca di capire come le cellule percepiscono e rispondono alle forze meccaniche. Per indagare su un possibile fattore meccanico nel collegamento di EphA2 al cancro al seno, Groves ha utilizzato una tecnica sviluppata dal suo gruppo in cui le membrane artificiali costituite da un doppio strato fluido di molecole lipidiche sono incorporate con matrici fisse di nanopunti d'oro. Ciò consente ai ricercatori di controllare la spaziatura o il trasporto di proteine e altre molecole cellulari poste sulle membrane.
Per questo studio, Groves e i suoi colleghi hanno utilizzato matrici di nanopunti d'oro per presentare ostacoli definiti al movimento e all'assemblaggio dei cluster EphA2/ephrin-A1. I ligandi efrina-A1 potrebbero legarsi alla membrana, che ha permesso ai cluster di essere mobili, o ai nanopunti, che immobilizzava i grappoli, o ad entrambi. I ricercatori hanno lavorato con linee di cellule del cancro al seno che hanno livelli simili di espressione di EphA2 e includevano MDA-MB-231, una linea altamente invasiva e tumorigenica, e MCF10A, una linea relativamente benigna e non cancerogena.
"Quando vediamo cellule che hanno gli stessi livelli di EphA2 ma l'MDA-MB-231 è inceppato mentre l'MCF10A no, allora possiamo dire che è qualcosa che va oltre i numeri di EphA2 che conta, qualcosa sul modo in cui l'EphA2 è collegato al resto della cellula che è erroneamente correlato, "Dice Groves. "Le nostre osservazioni suggeriscono che il citoscheletro è il colpevole e che i farmaci che modulano il citoscheletro potrebbero anche modulare terapeuticamente il clustering di EphA2, riducendo così il comportamento patologico."