Un nuovo metodo ad alta risoluzione sviluppato da un team internazionale di scienziati tra cui Robert Tampé e Ralph Wieneke della Goethe University di Francoforte consente ora per la prima volta l'identificazione e la quantificazione precise delle interazioni di un recettore con due ligandi contemporaneamente. Credito:GU
I processi di segnalazione negli organismi sono governati da specifiche interazioni extracellulari e intracellulari e coinvolgono centinaia di diversi recettori funzionalmente altamente versatili situati nelle membrane cellulari. Per gli scienziati che desiderano comprendere i processi di segnalazione la situazione è resa più complessa dal fatto che i recettori non solo sono distribuiti in modo non uniforme e spesso sono in grado di legare più di un ligando, ma anche dal fatto che lo stesso tipo di recettore è in grado di legare fortemente un ligando, debolmente o non tutti. Sono urgentemente necessari nuovi metodi che consentano quantificazioni precise di interazioni così complesse.
Un nuovo metodo ad alta risoluzione sviluppato da un team internazionale di scienziati tra cui Robert Tampé e Ralph Wieneke della Goethe University di Francoforte consente ora per la prima volta l'identificazione e la quantificazione precise delle interazioni di un recettore con due ligandi contemporaneamente. Il nuovo metodo è stato pubblicato nell'ultima edizione della rivista Comunicazioni sulla natura .
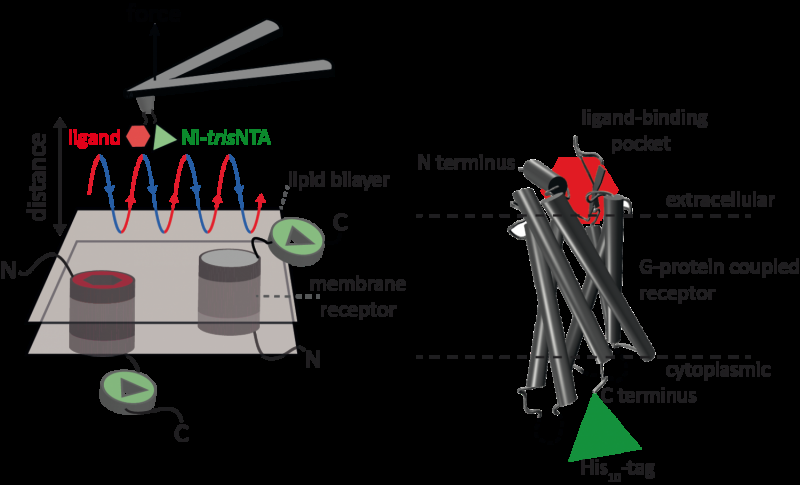
La microscopia a forza atomica (AFM) è una potente tecnica per la caratterizzazione su nanoscala delle superfici. Si avvale di un cantilever con punta estremamente fine. La microscopia a forza atomica basata sulla curva forza-distanza (AFM basata su FD) combina l'imaging ad alta risoluzione e la spettroscopia di forza a singola molecola. Negli studi che utilizzano campioni biologici, la punta AFM si avvicina e si ritrae dal campione per ogni pixel. I metodi AFM basati su FD utilizzano diversi rivestimenti della punta AFM come cassetta degli attrezzi e tali metodi hanno compiuto notevoli progressi negli ultimi anni. Per il rilevamento di specifici siti di legame, l'AFM basato su FD richiede il fissaggio di un ligando alla punta dell'AFM. Mentre si modellano i complessi proteici in una membrana, tali punte AFM funzionalizzate possono quindi misurare le interazioni del ligando legato alla proteina. Non era stato possibile visualizzare i recettori di membrana singola e rilevare contemporaneamente le loro interazioni con più di un ligando, ma il nuovo metodo ha superato questo ostacolo.
Per la loro prova di principio, gli scienziati hanno utilizzato il recettore 1 attivato dalla proteasi umana (PAR1), uno della grande famiglia dei recettori di membrana accoppiati a proteine G. I GPCR mediano la maggior parte delle risposte cellulari agli ormoni e ai neurotrasmettitori, oltre ad essere responsabile della visione, olfatto e gusto. I GPCR possono coesistere in diversi stati funzionali nella membrana cellulare e possono legare vari ligandi con diversa forza o affinità. Il GPCR PAR1 è attivato dalla trombina proteasi della coagulazione che innesca cascate di segnalazione per avviare risposte cellulari che aiutano a orchestrare l'emostasi, trombosi, infiammazione e possibilmente anche riparazione dei tessuti. Con l'aiuto del loro nuovo metodo AFM basato su FD, è stato possibile visualizzare il PAR1 umano nei proteoliposomi rilevando contemporaneamente le interazioni extracellulari e intracellulari di PAR1 con due ligandi. La chimica di superficie e il metodo nanoscopico sviluppati sono applicabili a una serie di sistemi biologici in vitro e in vivo.