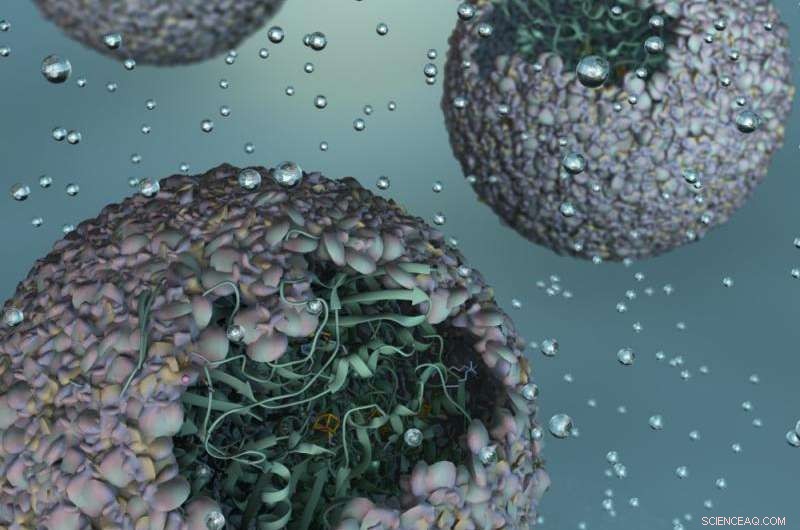
Rappresentazione artistica di P22-Hyd, un nuovo biomateriale creato incapsulando un enzima che produce idrogeno all'interno di un guscio virale. Credito:Università dell'Indiana
Gli scienziati dell'Università dell'Indiana hanno creato un biomateriale altamente efficiente che catalizza la formazione di idrogeno, metà del "Santo Graal" della scissione dell'H2O per produrre idrogeno e ossigeno per alimentare auto economiche ed efficienti che funzionano ad acqua.
Un enzima modificato che guadagna forza dall'essere protetto all'interno del guscio proteico - o "capside" - di un virus batterico, questo nuovo materiale è 150 volte più efficiente della forma inalterata dell'enzima.
Il processo di creazione del materiale è stato recentemente riportato in "Catalizzanti biomolecolari autoassemblanti per la produzione di idrogeno" sulla rivista Chimica della natura .
"Essenzialmente, abbiamo preso la capacità di un virus di autoassemblare una miriade di blocchi genetici e abbiamo incorporato un enzima molto fragile e sensibile con la straordinaria proprietà di assorbire protoni ed espellere gas idrogeno, " ha detto Trevor Douglas, l'Earl Blough Professor of Chemistry presso il Dipartimento di Chimica dell'IU Bloomington College of Arts and Sciences, che ha condotto lo studio. "Il risultato finale è una particella simile a un virus che si comporta come un materiale altamente sofisticato che catalizza la produzione di idrogeno".
Altri scienziati IU che hanno contribuito alla ricerca sono stati Megan C. Thielges, un assistente professore di chimica; Ethan J. Edwards, un dottorato di ricerca alunno; e Paul C. Jordan, un ricercatore post-dottorato presso Alios BioPharma, chi era un IU Ph.D. studente al momento dello studio.
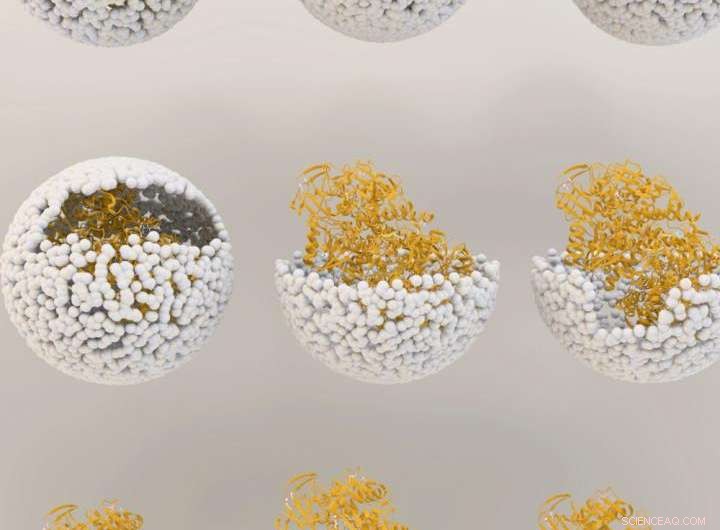
Illustrazione che mostra il rilascio di NiFe-idrogenasi dall'interno del guscio del virus, o "capside", del batteriofago P22. Credito:Università dell'Indiana
Il materiale genetico utilizzato per creare l'enzima, idrogenasi, è prodotto da due geni del batterio comune Escherichia coli, inserito all'interno del capside protettivo utilizzando metodi precedentemente sviluppati da questi scienziati IU. I geni, hyaA e hyaB, sono due geni in E. coli che codificano per le subunità chiave dell'enzima idrogenasi. Il capside proviene dal virus batterico noto come batteriofago P22.
Il biomateriale risultante, chiamato "P22-Hyd, " non solo è più efficiente dell'enzima inalterato, ma viene anche prodotto attraverso un semplice processo di fermentazione a temperatura ambiente.
Il materiale è potenzialmente molto meno costoso e più rispettoso dell'ambiente da produrre rispetto ad altri materiali attualmente utilizzati per creare celle a combustibile. Il costoso e raro metallo platino, Per esempio, è comunemente usato per catalizzare l'idrogeno come carburante in prodotti come le concept car di fascia alta.
"Questo materiale è paragonabile al platino, tranne che è veramente rinnovabile, " Douglas ha detto. "Non è necessario estrarlo; puoi crearlo a temperatura ambiente su larga scala utilizzando la tecnologia di fermentazione; è biodegradabile. È un processo molto ecologico per realizzare un materiale sostenibile di fascia alta".
Inoltre, P22-Hyd rompe i legami chimici dell'acqua per creare idrogeno e funziona anche al contrario per ricombinare idrogeno e ossigeno per generare energia. "La reazione funziona in entrambe le direzioni:può essere utilizzata come catalizzatore per la produzione di idrogeno o come catalizzatore per celle a combustibile, " ha detto Douglas.
La forma dell'idrogenasi è una delle tre presenti in natura:di-ferro (FeFe)-, solo ferro (solo Fe) e nichel-ferro (NiFe)-idrogenasi. La terza forma è stata selezionata per il nuovo materiale grazie alla sua capacità di integrarsi facilmente nei biomateriali e di tollerare l'esposizione all'ossigeno.
La NiFe-idrogenasi ottiene anche una resistenza significativamente maggiore dopo l'incapsulamento alla rottura da sostanze chimiche nell'ambiente, e conserva la capacità di catalizzare a temperatura ambiente. NiFe-idrogenasi inalterata, al contrario, è altamente suscettibile alla distruzione da sostanze chimiche nell'ambiente e si rompe a temperature superiori alla temperatura ambiente, entrambi i quali rendono l'enzima non protetto una scelta sbagliata per l'uso nella produzione e in prodotti commerciali come le automobili.
Queste sensibilità sono "alcune delle ragioni principali per cui gli enzimi non sono stati all'altezza delle loro promesse tecnologiche, " Ha detto Douglas. Un altro è la loro difficoltà a produrre.
"Nessuno ha mai avuto modo di creare una quantità sufficiente di questa idrogenasi nonostante il suo incredibile potenziale per la produzione di biocarburanti. Ma ora abbiamo un metodo per stabilizzare e produrre grandi quantità di materiale e enormi aumenti di efficienza, " Egli ha detto.
Lo sviluppo è altamente significativo secondo Seung-Wuk Lee, professore di bioingegneria all'Università della California-Berkeley, che non faceva parte dello studio.
"Il gruppo di Douglas ha guidato lo sviluppo di nanomateriali a base di proteine o virus negli ultimi due decenni. Questo è un nuovo lavoro pionieristico per produrre combustibili verdi e puliti per affrontare il problema energetico del mondo reale che affrontiamo oggi e avere un impatto immediato nella nostra vita nel prossimo futuro, " ha detto Lee, il cui lavoro è stato citato in un rapporto del Congresso degli Stati Uniti sull'uso dei virus nella produzione.
Al di là del nuovo studio, Douglas e i suoi colleghi continuano a trasformare P22-Hyd in un ingrediente ideale per l'energia dell'idrogeno, studiando modi per attivare una reazione catalitica con la luce solare, invece di introdurre elezioni con metodi di laboratorio.
"Incorporare questo materiale in un sistema a energia solare è il prossimo passo, " ha detto Douglas.