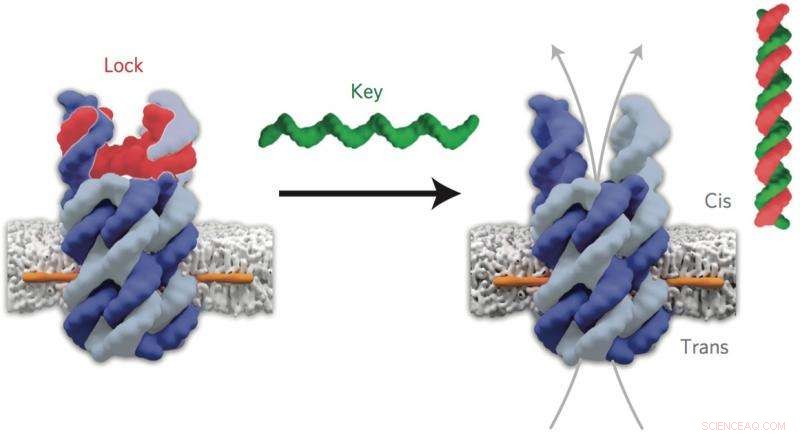
Il DNA 'lucchetto' (rosso) del nanoporo chiuso si lega al DNA 'chiave' (verde) per aprire il canale. Credito:Jonathan Burns et al. Nanotecnologia della natura, DOI 10.1038/nnano.2015.279
Il DNA è stato utilizzato come "mattone molecolare" per costruire pori sintetici bio-ispirati che miglioreranno il modo in cui i farmaci vengono somministrati e contribuiranno a far progredire il campo della biologia sintetica, secondo gli scienziati di UCL e Nanion Technologies.
Lo studio, pubblicato oggi in Nanotecnologia della natura e finanziato dal Biotechnology and Biological Sciences Research Council (BBSRC), Leverhulme Trust e UCL Chemistry, mostra come il DNA può essere utilizzato per costruire pori stabili e prevedibili che hanno una forma e una carica definite per controllare quali molecole possono passare attraverso il poro e quando.
Autore principale, Dott. Stefan Howorka (Chimica dell'UCL), ha dichiarato:"I pori biologici naturali costituiti da proteine sono essenziali per trasportare carichi dentro e fuori le cellule biologiche, ma sono difficili da progettare da zero. Il DNA offre una strategia completamente nuova per la costruzione di pori sintetici altamente specifici che possiamo aprire e chiudere su richiesta. Abbiamo progettato i nostri pori per agire come delle porte:la porta si apre solo quando viene fornita la chiave giusta. Costruendo questi pori in vettori di farmaci, pensiamo che consentirà un targeting molto più preciso delle terapie".
Molte terapie, compresi i farmaci antitumorali, possono essere trasportati nel corpo in minuscoli vettori chiamati vescicole che sono mirati a diversi tessuti utilizzando marcatori biologici. In precedenza, il rilascio dei farmaci dall'interno delle vescicole è stato attivato con pareti delle vescicole che perdono indotte dalla temperatura o con canali peptidici inseriti, che sono meno rigidi e prevedibili del DNA.
Usando i mattoni del DNA, il team ha progettato pori con strutture predeterminate e proprietà definite che sono stati ancorati con precisione nelle pareti - o membrane - delle vescicole.
"I nostri pori assumono la forma di un barile aperto composto da sei doghe di DNA. Abbiamo progettato un cancello molecolare per chiudere un ingresso ma poi riaprire il canale quando una molecola specifica si lega. Sono stati fissati ancore con un'elevata affinità di membrana per legare l'acqua. -pori solubili nella membrana oleosa, " ha spiegato il primo autore, Dott. Jonathan Burns (Chimica dell'UCL).
Utilizzando tecniche di elettrofisiologia, i ricercatori hanno verificato che il poro attraversava verticalmente la superficie della membrana ed era stabile con una larghezza interna di 2 nm, che è una dimensione appropriata per il passaggio di piccole molecole di farmaci.
Il meccanismo di blocco e rilascio del cancello è stato quindi testato con tecniche di elettrofisiologia e con fluorofori, che sono di dimensioni equivalenti a piccole molecole. Poiché il poro del DNA aveva una carica netta negativa, i fluorofori con una carica netta negativa si muovono con maggiore facilità rispetto a quelli con una carica netta positiva, mostrando la selettività per cui il carico potrebbe uscire. La rimozione della serratura con una chiave corrispondente ha aumentato il traffico di 140 volte rispetto a una chiave non corrispondente.
Co-autore Astrid Seifert che lavora con il dottor Niels Fertig presso Nanion Technologies, ha dichiarato:"Siamo stati in grado di analizzare con precisione le prestazioni di ciascuno dei pori che abbiamo creato. Abbiamo prima inserito i pori nelle membrane e poi testato la risposta biofisica di ciascun canale utilizzando microchip avanzati. Non abbiamo solo sviluppato un nuovo modo di progettare altamente pori specifici ma anche un metodo automatizzato per testarne le proprietà in situ, che sarà importante per testare i pori utilizzati per la somministrazione mirata di farmaci in futuro".
I ricercatori hanno in programma di testare i pori sintetici in una varietà di scenari tra cui il rilascio di farmaci antitumorali alle cellule e lo sviluppo di pori che rilasciano biomolecole farmaceuticamente attive.
Il dottor Howorka ha aggiunto, "Il nostro approccio è un grande passo avanti nella costruzione e nell'utilizzo di strutture biologiche sintetiche e promette una nuova era nella progettazione dei pori e nella biologia sintetica. Abbiamo dimostrato un controllo così preciso sul comportamento del poro, sia in termini di selettività che in termini di reattività, riteniamo che il metodo apra la strada a un'ampia gamma di applicazioni, dalla somministrazione di farmaci al nanosensore".