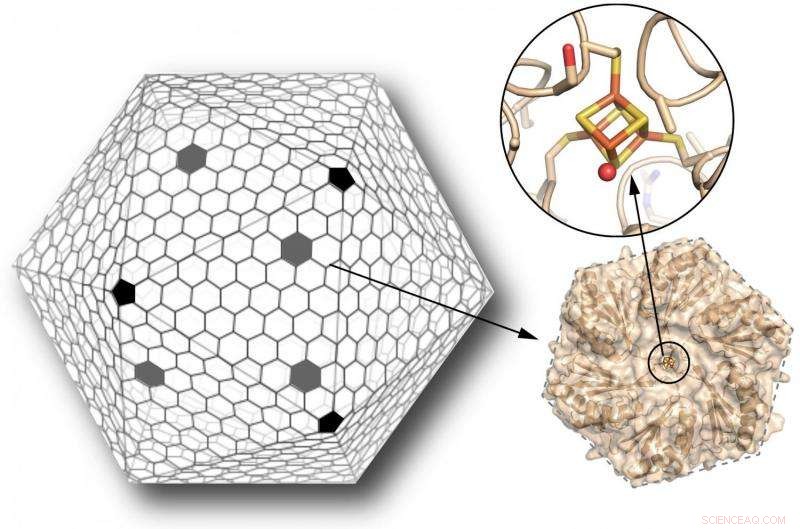
Il guscio di un microcompartimento batterico (o BMC) è composto principalmente da proteine esagonali, con proteine pentagonali che ricoprono i vertici, simile a un pallone da calcio (a sinistra). Gli scienziati hanno progettato una di queste proteine esagonali, normalmente privo di qualsiasi centro metallico, legare un grappolo ferro-zolfo (bastoncini arancioni e gialli, In alto a destra). Questo cluster può fungere da relè di elettroni per trasferire elettroni attraverso il guscio. L'introduzione di questa nuova funzionalità nel guscio di un BMC espande notevolmente le loro possibilità come bio-nanoreattori su misura. Credito:Clement Aussignargues/MSU; Cheryl Kerfeld e Markus Sutter/Berkeley Lab
Gli scienziati hanno per la prima volta riprogettato un elemento costitutivo di un nanocompartimento geometrico che si trova naturalmente nei batteri. Hanno introdotto un sito di legame metallico nel suo guscio che consentirà il trasferimento degli elettroni da e verso il compartimento. Ciò fornisce una funzionalità completamente nuova, ampliando notevolmente il potenziale dei nanocompartimenti per fungere da fabbriche chimiche su misura.
Gli scienziati sperano di adattare questo nuovo uso per produrre prodotti chimici di alto valore, come medicinali, su richiesta.
I robusti nanocompartimenti, che sono gusci poliedrici composti da lati a forma di triangolo e assomigliano a dadi a 20 facce, sono formati da centinaia di copie di soli tre diversi tipi di proteine. Le loro controparti naturali, noti come microcompartimenti batterici o BMC, racchiudono un'ampia varietà di enzimi che svolgono una chimica altamente specializzata nei batteri.
I ricercatori del Lawrence Berkeley National Laboratory (Berkeley Lab) del Dipartimento dell'energia hanno ideato strutture a guscio sintetiche derivate da quelle che si trovano in un batterio oceanico, Haliangium ocraceum, e ha riprogettato una delle proteine del guscio per fungere da impalcatura per un ammasso ferro-zolfo presente in molte forme di vita. Il cluster è noto come "cofattore" perché può fungere da molecola ausiliaria nelle reazioni biochimiche.
Le shell basate su BMC sono minuscole, durevole e naturalmente autoassemblante e autoriparabile, che li rende più adatti per una gamma di applicazioni rispetto alle nanostrutture completamente sintetiche.
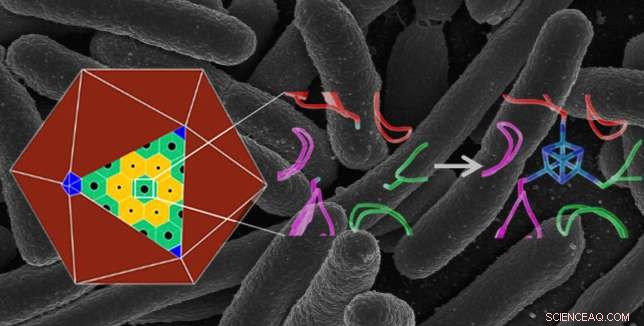
Struttura proteica naturale su scala atomica (al centro) in un microcompartimento batterico poliedrico (a sinistra), e una struttura ingegnerizzata (a destra) che lega un cluster ferro-zolfo (in blu), dandogli una nuova funzione. La proteina ingegnerizzata è stata prodotta in E. coli batteri:l'immagine di sfondo mostra un'immagine al microscopio elettronico a scansione di E. coli . Credito:Berkeley Lab, Istituto Nazionale della Salute
"Questa è la prima volta che qualcuno introduce funzionalità in un guscio. Abbiamo pensato che la funzionalità più importante da introdurre fosse la capacità di trasferire elettroni dentro o fuori il guscio, " ha detto Cheryl Kerfeld, un biologo strutturale al Berkeley Lab e autore corrispondente in questo studio. Il gruppo di ricerca di Kerfeld si concentra sui BMC. Kerfeld tiene appuntamenti congiunti con la divisione di biofisica molecolare e bioimmagine integrata (MBIB) del Berkeley Lab, UC Berkeley e il laboratorio di ricerca sulle piante MSU-DOE presso la Michigan State University (MSU).
"Ciò aumenta notevolmente la versatilità dei tipi di sostanze chimiche che è possibile incapsulare nel guscio e lo spettro dei prodotti da produrre, " ha detto. "In genere, i gusci sono pensati come semplici barriere passive."
I ricercatori hanno utilizzato i raggi X presso l'Advanced Light Source (ALS) del Berkeley Lab per mostrare, in 3-D e su scala atomica, come il cluster ferro-zolfo introdotto si lega alla proteina ingegnerizzata.
Lo studio è ora online nel Giornale della Società Chimica Americana .
Gli enzimi all'interno dei BMC naturali possono convertire l'anidride carbonica in composti organici che possono essere utilizzati dai batteri, isolare composti tossici o volatili dalla cellula circostante, ed effettuano altre reazioni chimiche che forniscono energia alla cellula.
In questo studio, i ricercatori hanno introdotto l'ammasso ferro-zolfo nei minuscoli pori del blocco costitutivo del guscio. Questa proteina ingegnerizzata funge da relè di elettroni attraverso il guscio, che è fondamentale per controllare la reattività chimica delle sostanze all'interno del guscio.
Clement Aussignargues, l'autore principale dello studio e ricercatore post-dottorato presso il MSU-DOE Plant Research Laboratory nel Michigan, disse, "La bellezza del nostro sistema è che ora abbiamo tutti gli strumenti, in particolare la struttura cristallografica della proteina ingegnerizzata, modificare il potenziale redox del sistema, la sua capacità di assorbire elettroni (riduzione) o cedere elettroni (ossidazione).
"Se possiamo controllare questo, possiamo espandere la gamma di reazioni chimiche che possiamo incapsulare nel guscio. Il limite di queste applicazioni sarà quello che mettiamo dentro i gusci, non le conchiglie stesse."
Ha aggiunto, "Creare un nuovo microscomparto da zero sarebbe molto, molto complicato. Ecco perché prendiamo ciò che la natura ci ha messo davanti e cerchiamo di aggiungere qualcosa a ciò che la natura può fare".
Per progettare il sito di rilegatura in metallo, Il gruppo di Kerfeld ha dovuto prima risolvere le strutture degli elementi costitutivi del nanocompartimento da utilizzare come modello per il design. Questi elementi costitutivi si autoassemblano in gusci sintetici, che misurano appena 40 nanometri, o miliardesimi di metro, di diametro. La forma naturale delle conchiglie può essere fino a 12 volte più grande.
Il cofattore ferro-zolfo della proteina ingegnerizzata, che è stato prodotto in batteri E. coli, era molto stabile anche se sottoposto a diversi cicli redox, una caratteristica essenziale per applicazioni future, ha detto Aussignargues. "La proteina ingegnerizzata era anche più stabile della sua controparte naturale, che è stata una grande sorpresa, " ha detto. "Puoi trattarlo con cose che normalmente fanno cadere e rilassare le proteine".
Una delle principali sfide dello studio è stata quella di preparare la proteina ingegnerizzata in un ambiente privo di ossigeno per formare minuscoli cristalli che preservano al meglio la loro struttura e il loro cofattore per l'imaging a raggi X, ha detto Kerfeld. I cristalli sono stati preparati in un vano portaoggetti a tenuta d'aria presso la MSU, congelato, e poi spedito per studi sui raggi X presso l'ALS del Berkeley Lab e la sorgente di luce di radiazione di sincrotrone di Stanford dello SLAC National Accelerator Laboratory (SSRL).
Nel lavoro di follow-up, il team di ricerca sta esplorando come incorporare diversi centri metallici nei gusci BMC per accedere a una diversa gamma di reattività chimica, lei disse.
"Sto lavorando per incorporare un centro di metallo completamente diverso, che ha un potenziale di riduzione molto positivo rispetto al cluster ferro-zolfo, " ha detto Jeff Plegaria, un ricercatore post-dottorato presso il laboratorio di ricerca sulle piante MSU-DOE che ha contribuito all'ultimo studio. "Ma è lo stesso tipo di idea:far entrare o uscire gli elettroni dal compartimento".
Ha aggiunto, "Il prossimo passo è incapsulare proteine in grado di accettare elettroni nei gusci, e usarlo come sonda per osservare il trasferimento di elettroni dall'esterno del compartimento all'interno." Ciò avvicinerà i ricercatori alla creazione di tipi specifici di prodotti farmaceutici o altre sostanze chimiche.