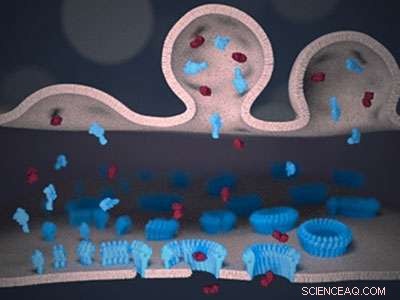
Vista schematica della sinapsi immunitaria tra un linfocita (in alto) e una cellula bersaglio (in basso). Perforin (blu) e granzyme (rosso) vengono consegnati alla sinapsi dalla membrana linfocitaria (in alto). La perforina si lega alla membrana bersaglio (in basso) e, seguendo un meccanismo di "poro in crescita", forma i pori transmembrana. I pori consentono ai granzimi tossici di passare attraverso la membrana bersaglio, e innescare la morte cellulare. Credito:Adrian Hodel, UCL
Come la forza di difesa naturale all'interno del nostro sistema immunitario attacca e distrugge gli invasori dannosi come le cellule infettate da virus e cancerose è stato visualizzato in dettaglio microscopico dagli scienziati dell'UCL, Birkeck, Università di Londra, Peter MacCallum Cancer Center e Monash University, Australia.
La ricerca, pubblicato oggi in Nanotecnologia della natura , approfondisce la comprensione del ruolo critico della proteina chiamata "perforina" in un sistema immunitario funzionante, portandoci un passo più vicino a nuove terapie con il potenziale di potenziare o inibire il suo impatto quando necessario.
Il professor Bart Hoogenboom (UCL Physics &Astronomy e London Centre for Nanotechnology) e la professoressa Helen Saibil (Birkbeck, University of London) ha utilizzato la microscopia a forza atomica e la microscopia elettronica per rivelare con precisione come un sottoinsieme di globuli bianchi, chiamati linfociti citotossici (o cellule T killer), mostrano una notevole efficienza nel perforare prima le loro vittime e poi iniettare enzimi velenosi per liberare il corpo dalla malattia.
Utilizzando una forma di microscopica CCTV, è stato mostrato come la perforina si lega alla membrana protettiva che circonda le cellule nocive. Il professor Hoogenboom ha dichiarato:"Il nostro sistema immunitario ha bisogno di praticare fori nelle cellule cancerose e infette da virus per liberarsene, ma non è possibile acquistare tali trapani in un negozio di bricolage. Abbiamo ora mostrato come si autoassembla questi trapani sul posto mettendo insieme più molecole di perforina in strutture ad anello, lasciando minuscoli buchi - solo decine di nanometri di diametro."
Professore Associato Ilia Voskoboinik, un co-autore principale (Peter MacCallum Cancer Center), ha detto:"Per uccidere le cellule infette da virus o cancerose, perforin deve essere veloce ed efficiente. I nostri esperimenti a Melbourne mostrano che i pazienti nati con perforina alterata possono presentare insufficienza fatale del sistema immunitario e hanno anche un rischio maggiore di sviluppare tumori del sangue.
"Questo era del tutto coerente con i dati microscopici ottenuti a Londra, il che mostra che l'efficacia della perforina è fortemente ostacolata anche se solo un piccolo numero delle molecole di perforina è anormale. Questa nuova comprensione ci avvicina di un passo alle terapie mirate che possono rafforzare il potere di produzione di perforina del corpo per scongiurare le malattie. Potremmo anche inibire la sua funzione per prevenire il rigetto dei trapianti di organi, quando accettare tessuti o cellule estranee può invece salvare la vita".
Per filmare le performance in azione, gli scienziati hanno utilizzato la microscopia a forza atomica nel laboratorio del professor Hoogenboom presso il London Centre for Nanotechnology presso l'UCL. Questo tipo di microscopia utilizza un ago ultrafine per sentire piuttosto che vedere la perforina su una membrana bersaglio, simile a una persona cieca che legge il Braille. L'ago scansiona ripetutamente la superficie per produrre un'immagine che si aggiorna abbastanza velocemente da tenere traccia di come le molecole di perforina si uniscono e tagliano i buchi nella membrana.
Inizialmente, perforin è apparso come una sfocatura su queste immagini. Però, una volta che alcune molecole di perforina sono state inserite insieme nella membrana, potrebbero essere identificati più chiaramente e mostrati per reclutare più perforina per far crescere così i pori transmembrana.
Registrando anche istantanee statiche a una risoluzione più elevata utilizzando la microscopia elettronica, Il team del professor Saibil è riuscito a stimare, per ogni assemblaggio di perforin, il numero di molecole in ogni fase del processo. Ciò ha confermato un cambiamento da piccoli gruppi di perforina poco impacchettati sulla membrana a pori transmembrana più grandi e più strettamente legati.