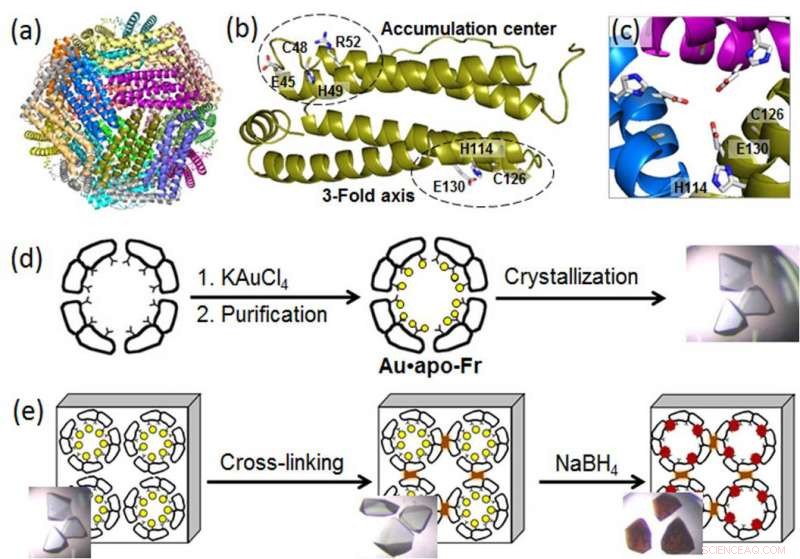
(a) Struttura della molecola di ferritina 24 mer; (b) un monomero di ferritina con i siti di legame del metallo; (c) un canale simmetrico a 3 assi; (d) preparazione e cristallizzazione di ferritina contenente Au; (e) reticolazione del cristallo di ferritina e riduzione degli ioni Au (cerchi gialli) in atomi di Au (0) che formano nanocluster (particelle marroni). Credito:Istituto di tecnologia di Tokyo
Gli scienziati del Tokyo Institute of Technology hanno utilizzato la cristallografia ad alta risoluzione per scoprire il meccanismo alla base della sintesi proteica delle nanoparticelle d'oro, fornendo una piattaforma per la progettazione di nanomateriali su misura per applicazioni biomediche.
Negli organismi viventi, gli ioni metallici liberi vengono immagazzinati e trasportati attraverso proteine assemblate in strutture altamente ordinate come gabbie proteiche attraverso una reazione chiamata biomineralizzazione. Questa sofisticata strategia biologica ha attirato l'attenzione dei biotecnologi che ipotizzano che le gabbie proteiche naturali di accumulo di ioni possano essere utilizzate per far crescere nanoparticelle metalliche con le proprietà desiderate.
Le nanoparticelle d'oro (AuNPs) sono note per le loro eccellenti funzioni nella catalisi, bioimmagini, consegna farmaci, e terapia; perciò, la sintesi di AuP con dimensioni e forme controllate è molto importante per la loro applicazione in nanomedicina. Negli scaffold proteici, Gli AuNP sono formati da un processo sequenziale che coinvolge la deposizione e l'agglomerazione dell'oro in piccoli nanocluster che fungono da centri di nucleazione per la crescita di AuNP. Però, il meccanismo dinamico alla base della formazione di nanocluster d'oro in ambienti proteici rimane poco chiaro.
Per divulgare i processi molecolari alla base della crescita di AuNP nelle nanogabbie proteiche, un gruppo di ingegneri biomolecolari del Tokyo Institute of Technology, guidato da Takafumi Ueno, ha utilizzato la cristallografia ad alta risoluzione e ha analizzato la formazione di nanocluster d'oro nella ferritina. Una proteina intracellulare universale di accumulo di ferro prodotta da quasi tutti gli organismi viventi, la ferritina forma una nanogabbia di 24 subunità autoassemblata con due siti specifici di legame del metallo:il canale dell'asse triplice e il centro di accumulo (Figura). Poiché gli ioni d'oro hanno un'elevata affinità per lo zolfo, gli scienziati hanno modificato il centro di accumulo introducendo un ulteriore residuo di cisteina contenente zolfo per migliorare l'assorbimento dell'oro nella gabbia proteica. Quindi, hanno rinforzato i cristalli di ferritina contenenti Au mediante reticolazione in glutaraldeide (Figura) per mantenere la loro struttura reticolare. Queste modifiche hanno consentito la riduzione degli ioni d'oro nei cristalli e la determinazione delle posizioni di legame degli ioni d'oro all'interno della gabbia di ferritina mediante cristallografia ad alta risoluzione.
Nel passaggio successivo, gli ioni d'oro immobilizzati sono stati ridotti in atomi di Au(0) usando un agente riducente (NaBH4). Di conseguenza, gli scienziati hanno potuto osservare che l'oro ridotto agglomerato in nanocluster si è formato nei canali simmetrici 3 volte e nei centri di accumulo del metallo, che era dovuto al graduale movimento dell'oro e ai cambiamenti conformazionali degli amminoacidi circostanti.
I risultati ottenuti dal professor Ueno e dai suoi colleghi svelano il meccanismo alla base della formazione di nanocluster d'oro che dovrebbero fungere da centri di nucleazione per la successiva crescita di AuNP nell'ambiente proteico unico, fornendo una piattaforma per studi futuri sulla biomineralizzazione e la sintesi di nanoparticelle negli scaffold biomolecolari.