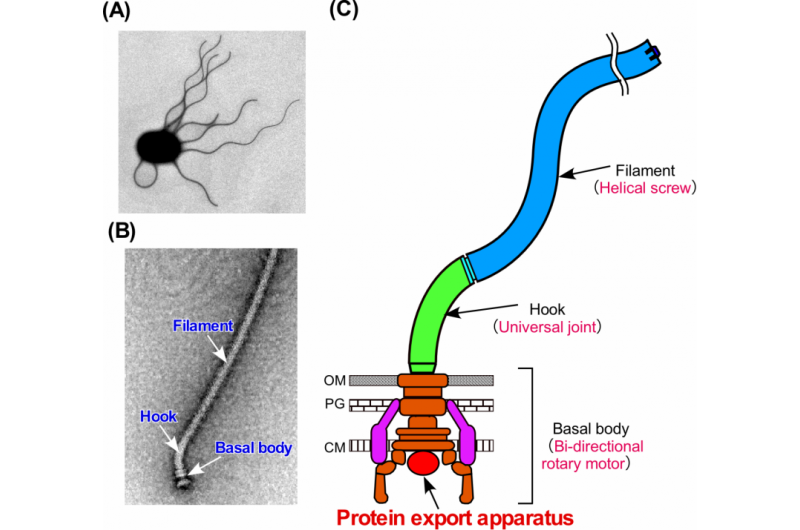
Figura 1. Il flagello batterico. (A) Micrografia elettronica di una cellula di Salmonella. (B) Micrografia elettronica del flagello di Salmonella. (C) Schema schematico del flagello. Il flagello è costituito da almeno tre parti:il corpo basale come motore rotativo bidirezionale, il gancio come giunto cardanico e il filamento come vite elicoidale. Credito:Università di Osaka
I ricercatori dell'Università di Osaka utilizzano la cristallografia a raggi X e la microscopia elettronica per risolvere l'assemblaggio dell'apparato del cancello di esportazione nella Salmonella. I nuovi dettagli di questa nanomacchina dovrebbero chiarire come i batteri infettano le cellule eucariotiche e presentare nuovi bersagli molecolari per la scoperta di farmaci.
Una delle più antiche nanomacchine in biologia è il flagello batterico. Questo apparato è evolutivo essenziale, conferendo ai batteri la capacità di muoversi. Il flagello condivide un'elevata somiglianza con un'altra struttura batterica, l'inietosoma, che, come suggerisce il nome, è il modo in cui alcuni batteri forniscono il loro contenuto per infettare un ospite. Un nuovo studio condotto da ricercatori dell'Università di Osaka rivela come una struttura specifica nel flagello e nell'iniettisoma, il complesso del gate di esportazione, assembla dinamicamente e come prevenire questo assemblaggio potrebbe rendere innocui i batteri. Lo studio può essere visto in PLOS Biologia .
Il professore associato Tohru Minamino presso la Graduate School of Frontier Biosciences ha studiato per molti anni il complesso del gate di esportazione utilizzando la microscopia elettronica. Il suo interesse per questo complesso è principalmente nell'ingegneria di nuove nanomacchine, ma ha realizzato che la stessa ricerca potrebbe avere implicazioni mediche.
"Ci sono molte somiglianze strutturali e funzionali tra le proteine flagellari e injectisome. Potrebbero essere buoni bersagli per inibire l'infezione batterica, " Egli ha detto.

Figura 2. Modello per la struttura ad anello FliP. Flip forma un omo-esamero. Il complesso FliO agisce come un'impalcatura per legarsi a FliP per facilitare la formazione dell'anello FliP. Credito:Università di Osaka
Il complesso di esportazione in Salmonella flagellum è costituito da cinque proteine transmembrana. Questi si riuniranno in sequenza per formare il cancello di esportazione, a cominciare dalla proteina FliP. Si ritiene che la porta di esportazione nell'injectisome di Salmonella si assembla in modo simile utilizzando cinque proteine omologhe. Minamino mostra che anche se non fa parte della struttura del cancello, una sesta proteina transmembrana, FliO, è essenziale per iniziare il montaggio del cancello.
"FliO funge da impalcatura per FliP per formare una struttura ad anello. Senza questo anello, le altre proteine transmembrana non seguiranno nel complesso di porta, " Egli ha detto.
Le immagini di microscopia elettronica hanno indicato che l'impalcatura FliO fa sì che FliP formi un esamero, che consente alle successive proteine transmembrana di unirsi all'assemblaggio. I calcoli elettrostatici hanno identificato quali amminoacidi specifici in FliP erano critici per le interazioni FliO-FliP e le interazioni FliP-FliP, fornendo bersagli candidati per farmaci sperimentali. Per dimostrare che FliO è necessario per il montaggio del cancello di esportazione e non per la struttura, Minamino ha dimostrato che la sovraespressione di FliP può bypassare il difetto FliO e procedere al completamento dell'apparato di gate di esportazione.
Sebbene FliO permetta a FliP di formare un esamero, la proteina omologa FliP nell'iniettisoma, Spa, forma un pentemero e un etero-esamero insieme a SpaR, la proteina omologa FliR. L'analisi computazionale ha suggerito che anche FliP potrebbe assumere questa struttura.
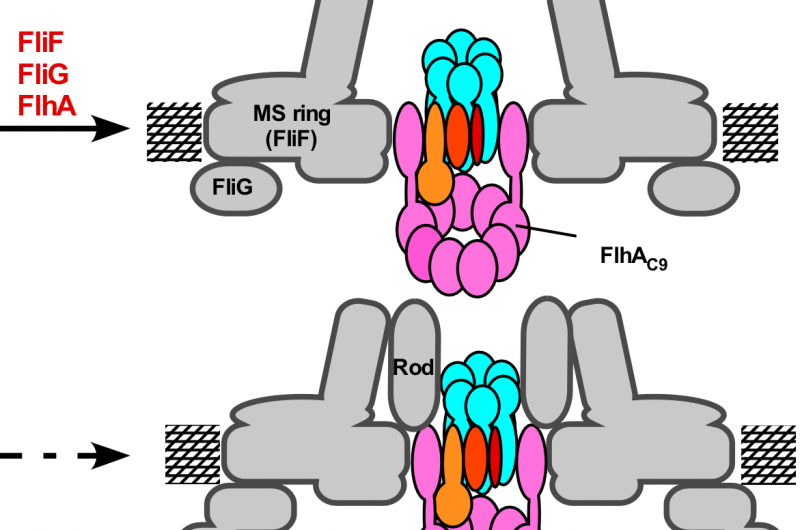
Figura 3. Modello per il processo di assemblaggio dell'apparato di esportazione flagellare. L'assemblaggio del complesso del gate di esportazione inizia con la formazione dell'anello FliP con l'aiuto del complesso FliO, seguito dall'assemblaggio di FliQ, FliR, e FlhB e infine di FlhA durante la formazione dell'anello MS nella membrana citoplasmatica. Al completamento della struttura ad anello C, il complesso dell'anello dell'ATPasi citoplasmatico si forma alla base del flagello, consentendo ai substrati di esportazione di entrare nella cavità centrale del complesso ad anello FliP. Credito:Università di Osaka
"Un numero significativo delle particelle dell'anello FliP che abbiamo analizzato potrebbe essere assegnato all'analisi rotazionale di 5 volte, così potevano formare pentameri. Siamo fiduciosi che FliP sia un buon modello per SpaP, " disse Minamo.
Identificazione della prima fase di montaggio del gate di esportazione, vale a dire l'oligmerizzazione di FliP attraverso interazioni FliO, suggerisce un potenziale modo per interrompere la patologia di batteri come la Salmonella.
"I nostri risultati suggeriscono che gli omologhi FliP dell'iniettisoma sono promettenti bersagli farmacologici, " disse Minamo.