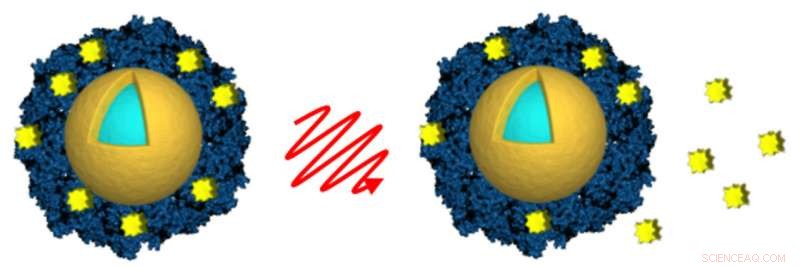
I ricercatori della Rice University e della Northwestern University hanno caricato nanoshell attivati dalla luce (oro e azzurro) con il farmaco antitumorale lapatinib (giallo) racchiudendo il farmaco in una busta di albumina (blu). La luce di un laser nel vicino infrarosso (al centro) è stata utilizzata per attivare a distanza il rilascio del farmaco (a destra) dopo che i nanoshell sono stati assorbiti dalle cellule tumorali. Credito:A. Goodman/Rice University
I ricercatori che studiano modi per fornire alte dosi di farmaci antitumorali all'interno dei tumori hanno dimostrato di poter utilizzare un laser e nanoparticelle d'oro attivate dalla luce per attivare a distanza il rilascio di farmaci antitumorali approvati all'interno delle cellule tumorali nelle colture di laboratorio.
Lo studio dei ricercatori della Rice University e della Northwestern University Feinberg School of Medicine appare nella Early Edition online di questa settimana del Atti dell'Accademia Nazionale delle Scienze . Ha impiegato nanoshell d'oro per fornire dosi tossiche di due farmaci, lapatinib e docetaxel, all'interno delle cellule del cancro al seno. I ricercatori hanno dimostrato di poter utilizzare un laser per attivare a distanza le particelle per rilasciare i farmaci dopo essere entrati nelle cellule.
Sebbene i test siano stati condotti con colture cellulari in laboratorio, la ricerca è stata progettata per dimostrare l'applicabilità clinica:le nanoparticelle non sono tossiche, i farmaci sono ampiamente utilizzati e la bassa potenza, il laser a infrarossi può brillare in modo non invasivo attraverso i tessuti e raggiungere i tumori diversi centimetri sotto la pelle.
"Negli studi futuri, abbiamo in programma di utilizzare una strategia da cavallo di Troia per ottenere i nanoshell carichi di droga all'interno dei tumori, " disse Naomi Halas, un ingegnere, chimico e fisico della Rice University che ha inventato i nanogusci d'oro e ha trascorso più di 15 anni a ricercare il loro potenziale antitumorale. "Macrofagi, un tipo di globuli bianchi che ha dimostrato di penetrare nei tumori, trasporterà i complessi farmaco-particella nei tumori, e una volta lì usiamo un laser per rilasciare i farmaci".
Co-autore Susan Clare, professore associato di chirurgia presso la Northwestern University Feinberg School of Medicine, ha affermato che lo studio PNAS è stato progettato per dimostrare la fattibilità dell'approccio del cavallo di Troia. Oltre a dimostrare che i farmaci potrebbero essere rilasciati all'interno delle cellule tumorali, lo studio ha anche mostrato che nei macrofagi, i farmaci non si sono staccati prima dell'innesco.
"Fare in modo che i farmaci chemioterapici penetrino nei tumori è molto impegnativo, "disse Chiara, anche un chirurgo del cancro al seno della Northwestern Medicine. "I farmaci tendono ad essere spinti fuori dai tumori piuttosto che assorbiti. Per ottenere una dose efficace sul tumore, i pazienti spesso devono assumere così tanto del farmaco che la nausea e altri effetti collaterali diventano gravi. La nostra speranza è che la combinazione di macrofagi e rilascio di farmaci innescato aumenti la dose efficace di farmaci all'interno dei tumori in modo che i pazienti possano assumerne di meno anziché di più".
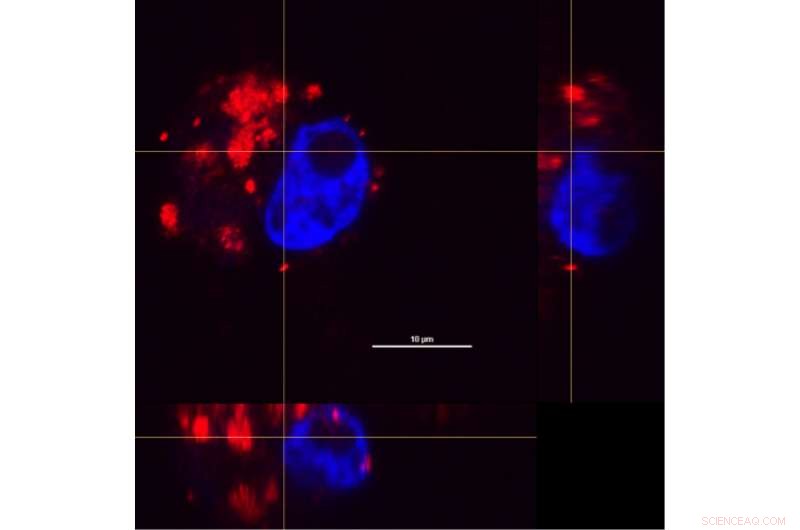
Combinando sezioni trasversali di una cellula macrofagica dalla x-, assi y e z, i ricercatori hanno potuto esaminare come i complessi nanoshell-farmaco (rosso) sono stati distribuiti all'interno delle cellule dopo un periodo di incubazione di 24 ore. Un colorante è stato utilizzato per distinguere il nucleo cellulare (blu). Credito:O. Neumann/Rice University
Se l'approccio funziona, Chiara ha detto, potrebbe causare meno effetti collaterali e potenzialmente essere usato per trattare molti tipi di cancro. Per esempio, uno dei farmaci in studio, lapatinib, fa parte di un'ampia classe di chemioterapie chiamate inibitori della tirosin-chinasi che prendono di mira specifiche proteine legate a diversi tipi di cancro. Altri farmaci approvati dalla Federal Drug Administration nella classe includono imatinib (leucemia), gefitinib (seno, polmone), erlotinib (polmone, pancreatico), sunitinib (stomaco, rene) e sorafenib (fegato, tiroide e reni).
"Tutti gli inibitori della tirosin-chinasi sono notoriamente insolubili in acqua, "ha detto Amanda Goodman, un alunna di riso e autore principale dello studio PNAS. "Come classe di farmaci, hanno scarsa biodisponibilità, il che significa che una proporzione relativamente piccola del farmaco in ogni pillola sta effettivamente uccidendo le cellule tumorali. Se il nostro metodo funziona per il lapatinib e il cancro al seno, potrebbe funzionare anche per gli altri farmaci della classe."
Halas ha inventato i nanoshell alla Rice negli anni '90. Circa 20 volte più piccolo di un globulo rosso, sono costituiti da una sfera di vetro ricoperta da un sottile strato d'oro. Le nanoshell possono essere sintonizzate per catturare energia da specifiche lunghezze d'onda della luce, compreso il vicino infrarosso (vicino IR), una lunghezza d'onda non visibile che attraversa la maggior parte dei tessuti del corpo. Nanospectra Bioscienze, un licenziatario di questa tecnologia, ha eseguito diversi studi clinici nell'ultimo decennio utilizzando nanoshell come agenti fototermici che distruggono i tumori con la luce infrarossa.
La collaborazione di Clare e Halas sulla somministrazione di farmaci a base di nanoshell è iniziata più di 10 anni fa. In lavori precedenti, hanno dimostrato che un laser a onda continua vicino all'infrarosso, lo stesso tipo che produce calore nelle applicazioni fototermiche dei nanoshell, potrebbe essere utilizzato per innescare il rilascio di farmaci dai nanoshell.
Nell'ultimo studio, Goodman ha contrastato l'uso dell'attivazione e dell'attivazione laser a onda continua con un laser a impulsi a bassa potenza. Utilizzando ogni tipo di laser, ha dimostrato il rilascio di farmaci attivato a distanza da due tipi di coniugati nanoguscio-farmaco. Un tipo utilizzava un DNA linker e il farmaco docetaxel, e l'altro ha impiegato un rivestimento di albumina proteica del sangue per intrappolare e trattenere il lapatinib. In ogni caso, Goodman ha scoperto di poter innescare il rilascio del farmaco dopo che i nanoshell sono stati assorbiti all'interno delle cellule tumorali. In entrambi i casi, inoltre, non ha riscontrato alcun rilascio prematuro misurabile di farmaci nei macrofagi.
Halas e Clare hanno detto che sperano di iniziare presto i test sugli animali della tecnologia e di avere un modello di topo stabilito che potrebbe essere utilizzato per i test.
"Sono particolarmente entusiasta del potenziale di lapatinib, " ha detto Clare. "La prima volta che ho sentito parlare del lavoro di Naomi, Mi chiedevo se potesse essere la risposta alla somministrazione di farmaci nell'interno anossico (impoverito di ossigeno) dei tumori dove si nascondono alcune delle cellule tumorali più aggressive. Come clinici, siamo sempre alla ricerca di modi per evitare che il cancro ritorni a distanza di mesi o anni, e spero che questo possa farlo".