Con i nuovi eptapeptidi, i ricercatori dell'IBB-UAB dimostrano che solo quattro diversi tipi di amminoacidi, distribuito in maniera specifica e abbinato sempre ad un altro quinto tipo, sono sufficienti per ottenere il codice completo necessario per formare fibre prioniche sintetiche. Credito:IBB-UAB
I ricercatori dell'Istituto di Biotecnologia e Biomedicina (IBB-UAB) hanno generato quattro peptidi, molecole più piccole delle proteine, in grado di autoassemblarsi in modo controllato per formare nanomateriali. La ricerca, pubblicato sulla rivista ACS Nano , è stato condotto da Salvador Ventura, Marta Díaz Caballero e Susanna Navarro (IBB-UAB), e comprendeva la collaborazione di Isabel Fuentes e Francesc Teixidor (Istituto di Scienza dei Materiali di Barcellona, ICMAB-CSIC).
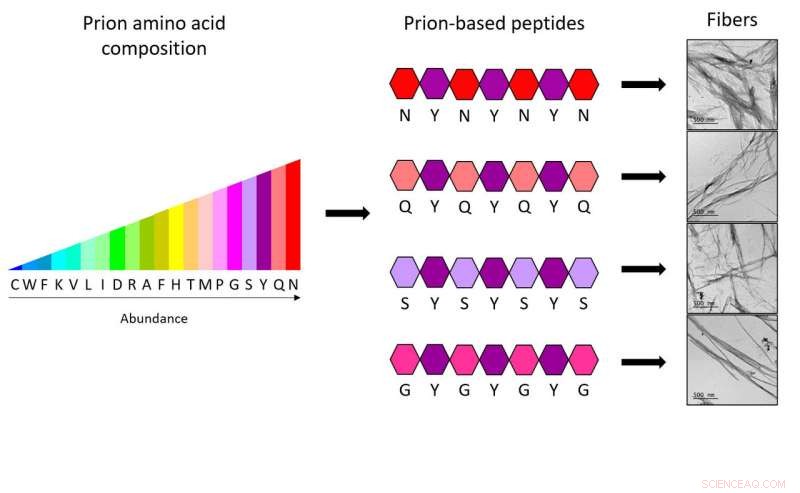
Le nuove molecole sono formate da una catena di sette amminoacidi, ciascuno dei quali è costituito da soli due amminoacidi, accelerando così e riducendo notevolmente i costi di creazione di strutture amiloidi sintetiche funzionali con cui generare nanomateriali per la biomedicina e la nanotecnologia.
Nelle biotecnologie, la generazione di strutture amiloidi sintetiche funzionali per formare nanostrutture imitando il processo di generazione naturale non è una novità. L'assemblaggio di proteine in fibre stabili permette di creare forme supramolecolari che nessuna proteina isolata può creare, e che vengono utilizzati come nanoconduttori, strutture fotovoltaiche, biosensori e catalizzatori.
Abbastanza recentemente, i ricercatori hanno iniziato a sintetizzare sequenze di proteine prioniche per formare nanomateriali. L'interesse per queste sequenze risiede nel fatto che le proteine si assemblano in maniera più lenta e controllata, formando altamente ordinato, nanostrutture non tossiche. Però, il fatto che la sequenza sia così lunga, con oltre 150 aminoacidi, rende molto difficile e costoso la sintesi.
"Abbiamo dimostrato che un design adeguato può consentire di ridurre la dimensione delle sequenze di prioni sintetici fino a soli 7 amminoacidi, conservando le stesse proprietà. I quattro peptidi che abbiamo fabbricato sono le strutture più corte di questo tipo create fino ad ora, e sono in grado di formare complessi di fibrille stabili, "dice Salvador Ventura, ricercatore presso l'IBB e il Dipartimento di Biochimica e Biologia Molecolare dell'UAB.
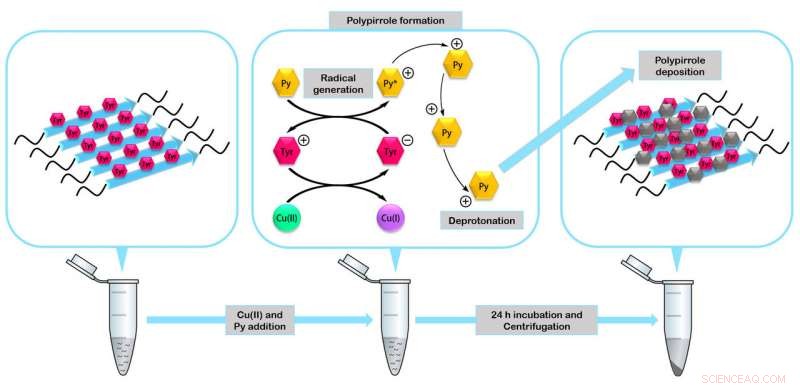
I peptidi si assemblano per formare enzimi in miniatura in grado di agire come catalizzatori nella formazione di nanomateriali come il polimero conduttivo polipirrolo. Credito:IBB-UAB
Nello studio, i ricercatori hanno verificato la stabilità e la funzionalità dei quattro peptidi fabbricati. Hanno costruito uno dei nanomateriali biologici più resistenti alla degradazione descritti fino ad oggi, nanocavi ricoperti di argento che possono fungere da nanoconduttori elettrici e mini enzimi fibrillari in grado di agire da catalizzatori nella formazione di nanomateriali organici.
Le nuove molecole hanno numerose applicazioni, ma i ricercatori puntano a concentrarsi sulla “generazione di nanoconduttori elettrici e utilizzare le conoscenze della struttura amiloide per generare fibre sintetiche capaci di essere catalizzatori per nuove reazioni chimiche. L'obiettivo finale sarà quello di generare materiali ibridi peptidico-inorganici capaci di fare reazioni complesse, come quelli creati dai fotosistemi delle piante, " precisa il ricercatore IBB.
domini prionici, al cuore della materia
Per generare nuovi peptidi, I ricercatori dell'IBB hanno basato il loro lavoro su sequenze specifiche di proteine prioniche, noti come domini prionici (PrD). "Abbiamo studiato quali aminoacidi sono più frequenti e come sono distribuiti in queste regioni, dimostrando che solo 4 diversi tipi di amminoacidi distribuiti in maniera specifica e sempre combinati da un quinto tipo di amminoacidi sono sufficienti per avere il codice completo necessario per formare le fibre prioniche sintetiche. Infatti, ciascuno degli eptapeptidi (mini-PrD) progettati contiene solo due diversi tipi di amminoacidi, "dice Salvador Ventura.
Lo studio dimostra la capacità di assemblaggio di mini-PrD in nanostrutture altamente ordinate, un processo ritenuto impossibile data la grande presenza di amminoacidi polari. I peptidi risultanti sono più polari di qualsiasi altro peptide di dimensioni simili usato fino ad ora per formare amiloidi sintetici; questo, Per esempio, permette loro di funzionare nelle stesse condizioni degli enzimi naturali.
Questo studio è servito per aiutare i ricercatori del gruppo IBB Protein Folding and Conformational Diseases, diretto dal Dott. Ventura, per aprire una nuova linea di ricerca focalizzata sulla progettazione di nanomateriali.
"Non abbiamo mai lavorato sulla nanotecnologia, ma allo stesso tempo l'abbiamo sempre avuto vicino, perché la nostra forza risiede nella conoscenza del meccanismo molecolare dell'assemblaggio delle proteine nelle strutture amiloidi. Da tempo lavoriamo per creare strategie con cui evitare questo fenomeno nelle malattie neurodegenerative. Questa conoscenza ci ha permesso di progettare nuove molecole che ora proponiamo per la fabbricazione di nuovi nanomateriali, " Conclude il dottor Ventura.