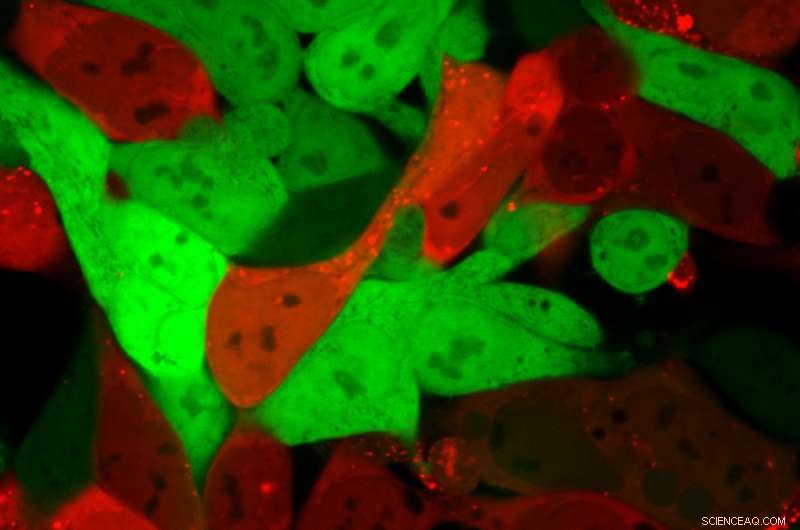
Le cellule che normalmente sono di un verde brillante diventano rosso vivo dopo che le nanoparticelle lipidiche hanno consegnato un carico di mRNA che codifica Cre. Le cellule rosse contengono l'mRNA, mentre le cellule verdi no. Credito:Daryll Vanover, Georgia Tech
Un nuovo processo di screening potrebbe accelerare notevolmente l'identificazione di nanoparticelle adatte a fornire RNA terapeutico nelle cellule viventi. La tecnica consentirebbe ai ricercatori di esaminare centinaia di nanoparticelle alla volta, identificare gli organi in cui si accumulano e verificare che possano trasportare con successo un carico di RNA nelle cellule viventi.
Sulla base di un lavoro noto come "codifica a barre del DNA, " la tecnica inserisce frammenti unici di DNA in ben 150 diverse nanoparticelle per test simultanei. Le nanoparticelle vengono quindi iniettate in modelli animali e lasciate viaggiare verso organi come il fegato, milza o polmoni. Le tecniche di sequenziamento genetico identificano quindi quali nanoparticelle marcate con DNA hanno raggiunto organi specifici.
In un articolo pubblicato il 1 ottobre sulla rivista Atti dell'Accademia Nazionale delle Scienze , un team di ricerca descrive un ulteriore passo avanti nel processo per verificare che le nanoparticelle siano entrate nelle cellule degli organi specifici. Oltre al codice a barre del DNA, i ricercatori hanno inserito in ogni nanoparticella un frammento di mRNA che viene trasformato in una proteina nota come "Cre". La proteina Cre genera un bagliore rosso, identificare le cellule in cui le nanoparticelle sono entrate e hanno consegnato con successo il farmaco mRNA, consentendo ai ricercatori di identificare quali nanoparticelle possono fornire farmaci a RNA alle cellule degli organi specifici.
"Questa tecnica, noto come Fast Indication of Nanoparticle Discovery (FIND), ci consentirà di identificare il vettore giusto in modo molto più rapido e meno costoso di quanto siamo stati in grado di fare in passato, " ha detto James E. Dahlman, assistente professore presso il dipartimento di ingegneria biomedica di Wallace H. Coulter presso la Georgia Tech e la Emory University. "Di conseguenza, le probabilità che saremo in grado di trovare portatori per tessuti specifici dovrebbero aumentare drasticamente".
La tecnica FIND sostituirebbe lo screening in vitro, che ha un successo limitato nell'identificare i portatori di nanoparticelle per le terapie genetiche. La ricerca è stata finanziata dal National Institutes of Health, e dalla Cystic Fibrosis Research Foundation, la Parkinson's Disease Foundation e il Bayer Hemophilia Awards Program.

James Dahlman, un assistente professore presso il Dipartimento di Ingegneria Biomedica di Wallace H. Coulter presso la Georgia Tech e la Emory University, contiene un chip microfluidico utilizzato per fabbricare nanoparticelle che potrebbero essere utilizzate per fornire geni terapeutici. Credito:Rob Felt, Georgia Tech
Le terapie basate su RNA e DNA potrebbero affrontare un'ampia gamma di malattie di origine genetica, compresa l'aterosclerosi, dove tali terapie possono essere in grado di invertire l'accumulo di placca nelle arterie. Le nanoparticelle utilizzate per fornire RNA e DNA nelle cellule sono costituite da diversi ingredienti i cui livelli possono essere variati, creando il potenziale per decine di migliaia di nanoparticelle diverse. Trovare la giusta combinazione di questi ingredienti per colpire cellule specifiche ha richiesto ampi processi di scoperta per tentativi ed errori che hanno limitato l'uso di terapie a RNA e DNA.
L'uso del processo di codifica a barre del DNA consente di testare simultaneamente centinaia di possibili combinazioni di nanoparticelle in un singolo animale, ma fino ad ora, i ricercatori potevano solo dire che la combinazione aveva raggiunto organi specifici. Esaminando quali cellule all'interno degli organi hanno il bagliore rosso, ora possono verificare che le nanoparticelle trasportassero i codici a barre e consegnassero farmaci mRNA funzionali nelle cellule.
Nella carta, i ricercatori riferiscono di aver scoperto due nanoparticelle che hanno consegnato in modo efficiente siRNA, sgRNA e mRNA alle cellule endoteliali nella milza. I ricercatori ritengono che la loro tecnica possa fornire RNA e DNA terapeutici a un'ampia varietà di tipi di cellule endoteliali, e forse anche al sistema immunitario e ad altri tipi di cellule.
"Il campo è stato in grado di somministrare funzionalmente farmaci genetici al fegato, e ora stiamo cercando di utilizzare la nostra tecnologia per fornire a diversi organi e tipi di cellule per consentire terapie per trattare tutti i tipi di cellule che si trovano nel fegato, "ha detto Cory Sago, il primo autore del documento e un dottorato di ricerca. candidato nel laboratorio di Dahlman. "Ora che abbiamo un sistema che ci consente di sondare queste domande a un livello di risoluzione molto specifico, ora vogliamo perseguire altri tipi di cellule in modo più efficiente".
Dahlman prevede di utilizzare rapidamente la nuova tecnologia.

James Dahlman, un assistente professore presso il Dipartimento di Ingegneria Biomedica di Wallace H. Coulter presso la Georgia Tech e la Emory University, viene mostrato nel suo laboratorio. Credito:Christopher Moore, Georgia Tech
"Speriamo di intraprendere progetti che normalmente richiederebbero anni e di completarne molti entro i prossimi 12 mesi, " ha detto. "FIND potrebbe essere utilizzato per trasportare tutti i tipi di farmaci a base di acido nucleico nelle cellule. Ciò potrebbe includere piccoli RNA, grandi RNA, DNA piccolo e DNA grande:molti tipi diversi di farmaci genetici che vengono ora sviluppati nei laboratori di ricerca".
Le sfide tecniche future includono la dimostrazione che l'identificazione di un'affinità per gli organi dei topi prevede quali particelle funzioneranno nel corpo umano, e che l'approccio funziona per diverse classi di terapie genetiche.
Sperimentalmente, Il laboratorio di Dahlman produce le nanoparticelle in tre stazioni di formulazione che richiedono circa 90 secondi per produrre ciascuno dei circa 250 campioni utilizzati. Le nanoparticelle risultanti vengono quindi esaminate per un intervallo di dimensioni adeguato, da 40 a 80 nanometri di diametro, prima di essere purificate e sterilizzate per l'iniezione negli animali.
Dopo tre giorni, i ricercatori separano le cellule che brillano di rosso e mettono in sequenza i frammenti di DNA al loro interno per identificare quali composizioni chimiche hanno avuto maggior successo nell'entrare nelle cellule di organi specifici. Le composizioni chimiche più promettenti vengono utilizzate per sviluppare un nuovo lotto di nanoparticelle candidate per un nuovo ciclo di screening, che richiede circa una settimana per essere completata.
"Vogliamo far evolvere le migliori particelle che possiamo, " Disse Sago. "Ognuno dei componenti è importante, e lavoriamo per ottenere ogni componente giusto per il tipo di cella che ci interessa. C'è molta ottimizzazione richiesta."