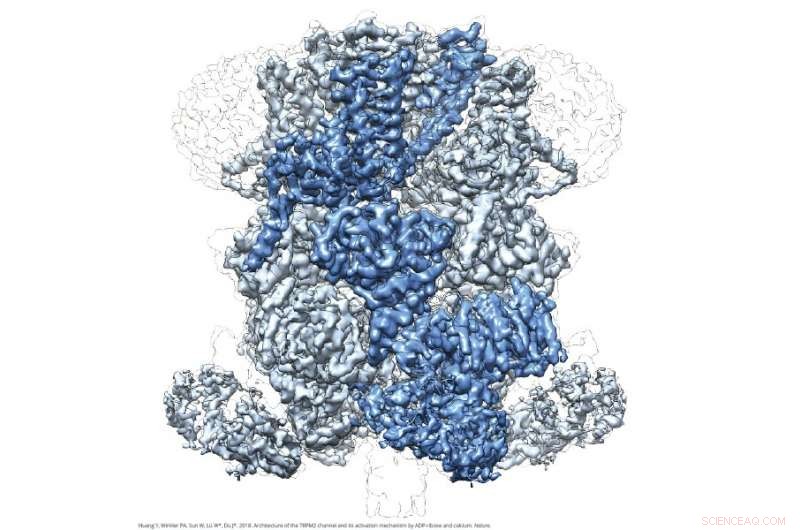
Immagine Cryo-EM di TRPM2. Credito:Wei Lü e Juan Du
Un team guidato dagli scienziati del Van Andel Research Institute (VARI) ha rivelato per la prima volta la struttura a livello atomico del TRPM2, una proteina che potrebbe essere un promettente bersaglio farmacologico per condizioni come il morbo di Alzheimer e il disturbo bipolare.
TRPM2 si trova in tutto il corpo ed è integralmente coinvolto nella regolazione della temperatura corporea interna, mediare le risposte immunitarie e governare l'apoptosi, la morte programmata delle cellule. È attivato da una serie di stimoli tra cui lo stress ossidativo, che deriva da squilibri chimici ed è legato a numerose condizioni neurologiche.
"TRPM2 è assolutamente fondamentale per una funzione sana ma, fino ad oggi, ci mancavano informazioni chiave sulla sua struttura e meccanismo d'azione, " ha detto Juan Du, dottorato di ricerca, un assistente professore al VARI e co-autore senior di uno studio che descrive la struttura di TRPM2, pubblicato oggi in Natura "La nostra speranza è che questi risultati agiscano come uno schema per la progettazione di farmaci migliori e disperatamente necessari per una serie di condizioni neurologiche".
Le immagini a livello atomico di TRPM2 raffigurano una struttura a campana, con una regione di dominio transmembrana sulla spalla della campana e un dominio NUDT9-H espanso sul labbro della campana. Rivelano anche un nuovo sito di legame farmacologico per ADPR, una molecola messaggera associata allo stress ossidativo e al metabolismo, che ribalta l'opinione prevalente che TRPM2 leghi ADPR al dominio NUDT9-H. Queste rivelazioni forniscono dettagli preziosi che potrebbero informare la progettazione di farmaci terapeutici per trattare le malattie legate alla temperatura e prevenire la morte neuronale nelle malattie neurodegenerative.
"Sebbene sappiamo da tempo che il TRPM2 è una componente vitale di molti processi biologici e un possibile bersaglio di farmaci, non sapevamo esattamente che aspetto avesse o come funzionasse, " disse Wei Lu, dottorato di ricerca, assistente professore al VARI e co-autore senior. "I risultati di oggi cambiano questo, e fare molta strada verso una comprensione più completa di queste molecole incredibilmente importanti".
TRPM2 appartiene alla superfamiglia TRP, un gruppo di proteine che mediano le risposte agli stimoli sensoriali, come il dolore, pressione, visione, temperatura e gusto. Ampiamente conosciuti come canali ionici, proteine come il TRP si annidano all'interno delle membrane delle cellule, fungendo da gatekeeper per i segnali chimici che entrano ed escono dalla cellula. Le otto proteine che compongono la sottofamiglia TRPM fanno parte di questo gruppo più ampio.
Ad oggi, TRPM2 è la quarta proteina TRPM ad avere la sua struttura risolta a livello atomico e la seconda proteina TRPM ad essere determinata a risoluzione atomica a VARI. In dicembre, Lü e Du hanno rivelato la struttura di TRPM4, che svolge un ruolo nella regolazione dell'afflusso di sangue al cervello. È stata la prima struttura di una proteina TRPM determinata a risoluzione atomica.
I risultati sono stati resi possibili dalla David Van Andel Advanced Cryo-Electron Microscopy Suite all'avanguardia di VARI, che consente agli scienziati di visualizzare alcuni dei più piccoli componenti della vita con dettagli squisiti. Il più grande microscopio di VARI, il Titano Krios, è così potente che può visualizzare le molecole 1/10, 000esimo della larghezza di un capello umano.