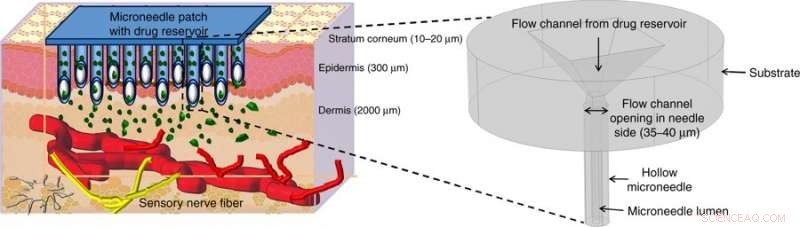
Consegna illustrata del farmaco mediante microaghi cavi (MN). I MN cavi perforano la pelle per raggiungere i nervi sensibili al dolore nella regione transdermica della pelle e rilasciano indolore il farmaco attraverso metodi di attuazione adeguati. La figura all'inizio mostra una vista ingrandita della struttura dei microaghi proposta in questo lavoro. Credito:Microsistemi e nanoingegneria, doi:https://doi.org/10.1038/s41378-018-0039-9.
I microaghi sono progettati per infondere farmaci per via transdermica (attraverso la pelle) e in modo relativamente indolore durante le applicazioni cliniche. In un recente studio, Richa Mishra e i suoi colleghi hanno sviluppato una nuova tecnica per convertire i film polimerici in una forma vetrosa di carbonio resistente alla frattura per sviluppare microaghi. Il dispositivo di somministrazione transdermica ottimizzata del farmaco è stato fabbricato utilizzando la fotolitografia per formare un microago biocompatibile e robusto per applicazioni precliniche.
Gli scienziati hanno prima generato una serie di verticali, tubi cavi realizzati con il polimero a base epossidica SU-8 su un substrato di silicio. Le microstrutture sono state affilate in forme aghiformi mediante trattamento termico in un forno privo di ossigeno e il prodotto finale era composto interamente da atomi di carbonio ordinati casualmente. La successiva caratterizzazione dei materiali ha incluso la nanoindentazione per misurare la rigidità della superficie. Le strutture vetrose in carbonio erano abbastanza robuste da penetrare nella pelle umana senza rompersi. I risultati dello studio sono stati pubblicati su Microsistemi e nanoingegneria .
Gli autori hanno dettagliato il processo convenzionale del sistema microelettromeccanico al carbonio (C-MEMS) utilizzato per fabbricare i microaghi. Nel processo, Mishra et al. utilizzato una fase di pirolisi scalabile e irreversibile, dove il precursore dei microaghi SU-8 premodellati è stato convertito in strutture vetrose di carbonio. Gli esperimenti sono stati condotti in atmosfera inerte ad alte temperature (~900 0 C) per mantenere la loro forma originale dopo il restringimento. Sulla conversione in carbonio vetroso, i microaghi hanno ereditato le proprietà associate di durezza, biocompatibilità, resistenza termica e chimica.
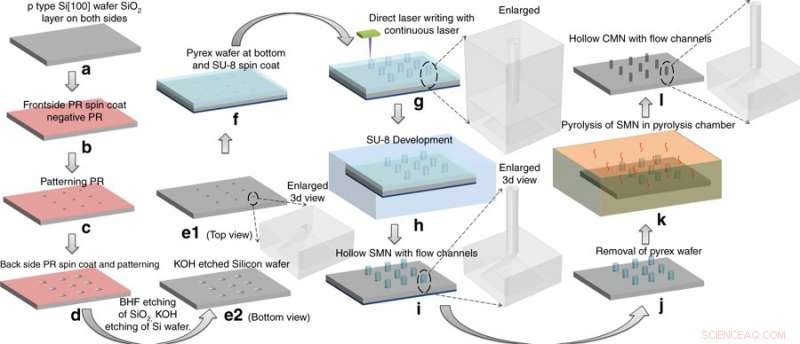
Processo di fabbricazione:conversione dei microaghi SU-8 (SMN) in microaghi vetrosi cavi (CMN) mediante pirolisi. Le strutture SMN si sono ridotte pur mantenendo la loro geometria complessiva. Credito:Microsistemi e nanoingegneria, doi:https://doi.org/10.1038/s41378-018-0039-9
I ricercatori hanno confrontato la durezza e il modulo di Young dei microaghi di carbonio e SU-8 per comprendere l'aumento della forza indotta dal processo C-MEMS. Successivamente è stato stimato il restringimento strutturale dei microaghi di carbonio durante la pirolisi. Mishra et al. ha condotto una caratterizzazione approfondita dei materiali con la spettroscopia a raggi X a dispersione di energia (EDX) per comprendere la chimica della superficie e la spettroscopia Raman per stimare la percentuale atomica di carbonio nella struttura cristallina del microago.
I risultati hanno confermato la composizione vetrosa dei microaghi. Ulteriori prove di compressione e flessione hanno determinato le forze massime che i microaghi potrebbero sopportare. I dispositivi potevano resistere a forze che erano di circa due ordini di grandezza superiori alle forze resistive della pelle. I dispositivi sono stati successivamente testati sulla superficie della pelle di un modello murino nello studio.
L'uso del carbonio in medicina non è nuovo; esempi includono applicazioni in articolazioni ortopediche, come fibre/compositi di carbonio negli interventi chirurgici ortopedici e come materiali negli strumenti chirurgici. Le proprietà delle fibre di carbonio per formare strutture simili a scaffold 3D hanno mostrato una capacità promettente nella rigenerazione del tessuto osseo. Le proprietà su misura del carbonio li hanno resi adatti alla fabbricazione di microaghi (MN) per la somministrazione transdermica di farmaci per la somministrazione avanzata di farmaci e vaccini.
Per competenza, I MN dovrebbero avere una lunghezza ottimale per un'efficace somministrazione del farmaco, ma sii abbastanza corto da evitare di causare dolore. Gli scienziati dei materiali stanno esplorando strategie per selezionare materiali e metodi clinicamente validi che possono essere tradotti commercialmente in un breve periodo di tempo.
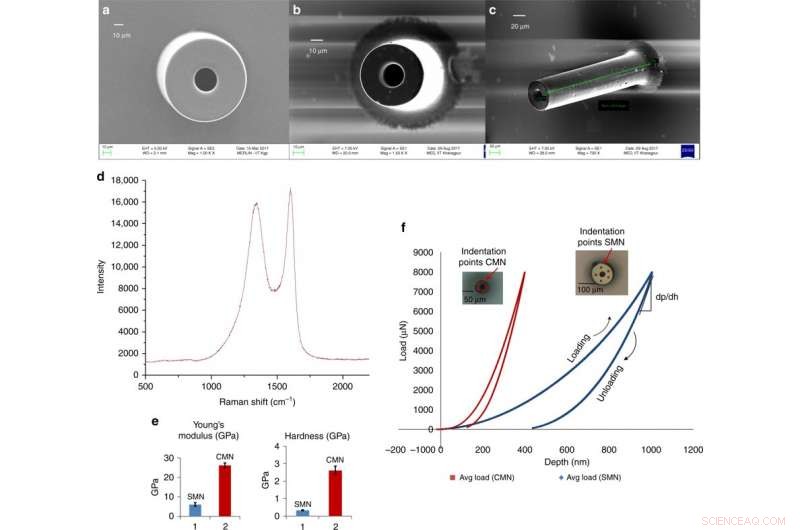
Microaghi vetrosi in carbonio per la somministrazione transdermica di farmaci derivati da un processo C-MEMS scalabile. a) Micrografia elettronica a scansione di un SMN (diametro esterno 100 μm, diametro interno 50 μm). b) Corrispondente MN pirolizzato. c) Vista inclinata della stessa CMN. d) Spettro Raman del microago di carbonio. e) Confronto del modulo di Young e della durezza per il SU-8 e il carbonio MN. f) Dati di carico e spostamento per una SMN e la corrispondente CMN pirolizzata. Credito:Microsistemi e nanoingegneria, doi:https://doi.org/10.1038/s41378-018-0039-9.
I requisiti chiave per i MN includono la biocompatibilità, forza e somministrazione controllata del farmaco. I MN solidi possono essere sviluppati con polimeri, silicio, acciaio, titanio e nichel tramite processi sottrattivi o additivi. Uno svantaggio dei MN solidi è la loro capacità limitata di somministrazione ottimale del farmaco. D'altra parte, i MN cavi possono essere collegati a un serbatoio di farmaco con pressione esterna per una somministrazione ottimale del farmaco.
Mishra et al. ha scelto il precursore SU-8 per la sua elevata forza di reticolazione, biocompatibilità, basso costo, polimerizzazione indotta dalla luce e compatibilità con il processo dell'industria microelettronica. Per fabbricare cavi, microaghi vetrosi in carbonio (CMN), il processo C-MEMS è stato inizialmente adattato per modellare i microaghi SU-8 (SMN) utilizzando la scrittura laser diretta, seguita dalla loro conversione in CMN vetrose tramite pirolisi. Le porte microfluidiche sono state incise in un wafer di silicio, secondo un precedente protocollo sviluppato dallo stesso gruppo di ricerca. I prodotti risultanti (CMN) sono stati caratterizzati per le loro proprietà meccaniche, compresa la durezza e il modulo di Young rispetto ai loro precursori SMN. I risultati hanno indicato che i CMN erano superiori.
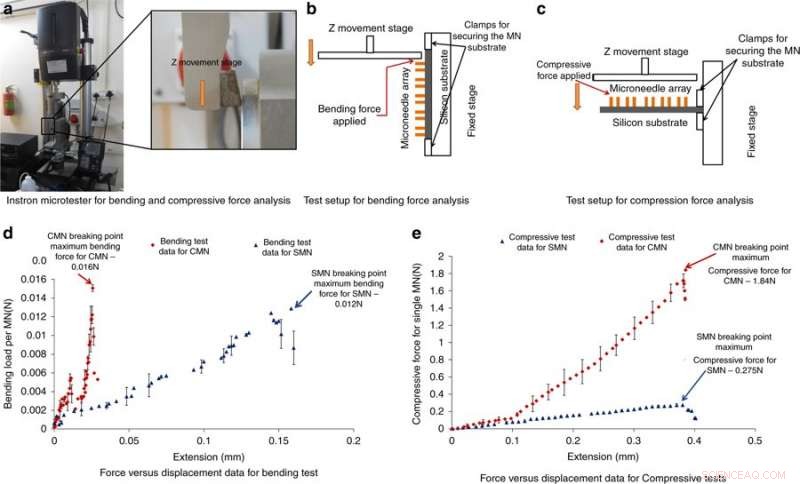
Microtester Instron per analisi e risultati della forza di flessione e compressione. a) Fotografia del microtester Instron impiegato per l'analisi della forza di flessione e compressione. b) Configurazione di prova per l'analisi della forza di flessione. c) Configurazione di prova per l'analisi della forza di compressione. d) Risultati forza/spostamento dalla prova di flessione. e) Risultati forza/spostamento dalla prova di compressione. Credito:Microsistemi e nanoingegneria, doi:https://doi.org/10.1038/s41378-018-0039-9
Mishra et al. osservato e quantificato le dimensioni dei precursori SMN e delle corrispondenti strutture CMN pirolizzate utilizzando immagini di microscopia elettronica a scansione (SEM). Dopo la pirolisi, il diametro e lo spessore della parete del microago sono diminuiti. I risultati EDX hanno mostrato un aumento della percentuale atomica di elementi di carbonio per MN di carbonio. L'assenza di azoto nella composizione del microago di carbonio indicava la sua rimozione durante il riscaldamento. La percentuale di contenuto di ossigeno era dovuta alla struttura CMN e al Si/SiO 2 superficie del substrato. La spettroscopia Raman ha mostrato la natura cristallina vetrosa della microstruttura finale mediante la verifica del prodotto di carbonio. I risultati concordano con studi precedenti.
Gli scienziati hanno ottenuto dati sullo spostamento del carico tramite nanoindentazione per le strutture separate di SU-8 e carbonio. Hanno calcolato la durezza e il modulo di elasticità utilizzando il modello Oliver Pharr. I risultati hanno mostrato una durezza di 0,33 GPa e un modulo di Young di 5,52 GPa per SMN. Alla conversione in CMN tramite pirolisi, i risultati dell'indentazione hanno mostrato una maggiore elasticità del materiale, la durezza è aumentata di otto volte a 2,62 GPa e il modulo di Young è aumentato di 4,8 volte a 26,97 GPa.
Per comprendere la capacità dei MN di resistere alle forze senza rotture durante l'inserimento nella pelle, Mishra et al. ha condotto misurazioni della forza di flessione e compressione della struttura. Tipicamente, un MN sperimenta resistenza durante la penetrazione della pelle, la forza applicata dovrebbe quindi essere maggiore della forza contraria. Per testare la flessione/compressione, gli MN sono stati caricati su un microtester Instron e una piastra metallica è stata spinta verso gli MN fino a quando non si sono rotti; se il carico applicato era inferiore alla forza massima di compressione o flessione, gli aghi non si romperanno. Un forte calo della forza di compressione o di flessione indicava un punto di frattura. I risultati hanno mostrato che i CMN erano molto più forti dei precursori, permettendo loro di superare la resistenza durante la penetrazione cutanea.
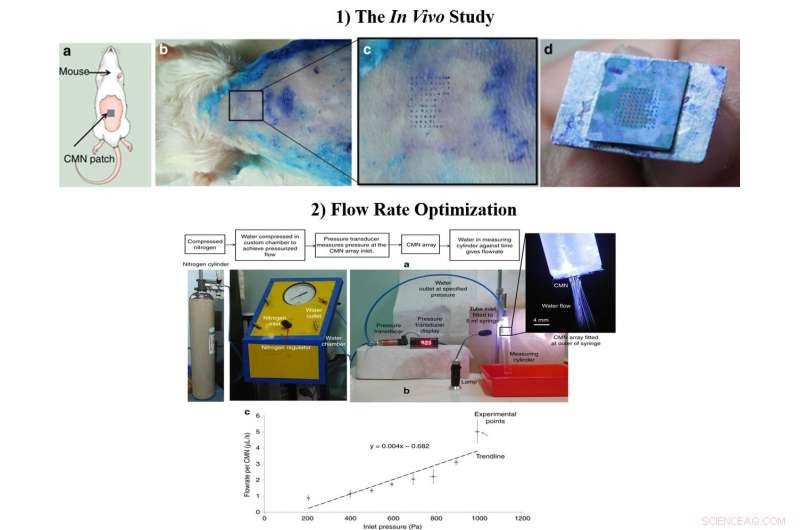
1) Lo studio in vivo a) Schema del test di inserzione di MN sui topi. b) Test di inserimento biologico eseguito su topi Swiss Albino di età compresa tra 6 e 8 settimane. c) Vista ingrandita dell'area cutanea perforata dai CMN. d) Array intatto di 10 × 10 dopo più inserimenti. 2) La portata ottimizzata, a) Configurazione di prova per la misurazione della portata. b) Portata per microago a diverse pressioni di ingresso. Credito:Microsistemi e nanoingegneria, doi:https://doi.org/10.1038/s41378-018-0039-9
Dopo aver confermato il carattere meccanico e la superiorità dei CMN cavi in laboratorio, Richa Mishra e collaboratori hanno condotto esperimenti in vivo per testare i CMN sulla pelle del topo. Una matrice di microaghi appena imbevuta di blu di metilene è stata premuta sulla pelle di un modello di topo albino svizzero e lentamente ritirata più volte. I segni dell'ago del blu di metilene erano visibili, i MN sono rimasti intatti dopo più inserimenti e una spaziatura dell'array di 500 µm era ottimale per ulteriori studi in laboratorio.
Gli scienziati hanno ottimizzato le dimensioni del flusso durante il processo di produzione e hanno incluso condotti microfluidici di dimensioni ridotte per una migliore funzionalità MN. Per testare le portate, hanno attaccato una siringa da 5 ml con una camera personalizzata contenente acqua deionizzata. Quando gli scienziati hanno misurato la portata media rispetto alla pressione per i singoli MN, i risultati hanno mostrato che la somministrazione del farmaco potrebbe essere infine controllata modificando la pressione di ingresso.
La tecnica definitiva di caratterizzazione dei materiali nello studio è stata la nanoindentazione, poiché il parametro quantificava la durezza superficiale e il modulo di Young per verificare la superiorità dei CMN. Il lavoro futuro includerà lo sviluppo della somministrazione controllata di farmaci, con una micropompa e un serbatoio del farmaco integrati nel design MN. In questo modo, gli scienziati mirano a sviluppare sistemi avanzati di somministrazione di farmaci e vaccini nel settore sanitario che siano efficienti in termini di costi, preciso e indolore per il paziente.
© 2019 Scienza X Rete