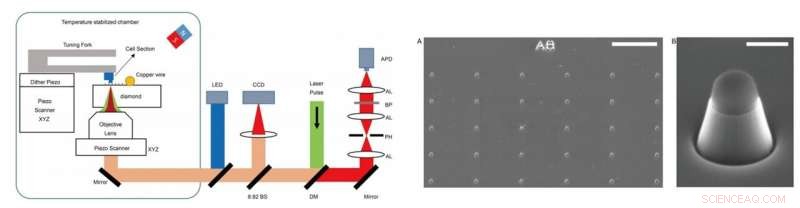
SINISTRA - Configurazione sperimentale. L'esperimento è stato condotto su un impianto autocostruito, che combinava la microscopia a risonanza magnetica (ODMR) rilevata otticamente con la microscopia a forza atomica (AFM). DM:specchio dicroico. BP:filtro passa-banda funzionante a 650–775 nm. APD:fotodiodo da valanga. CCD:dispositivo ad accoppiamento di carica. LED:diodo ad emissione luminosa di 470 nm. AL:lente acromatica. PH:foro stenopeico della dimensione di 30 μm. BS:divisore di raggio. A DESTRA - Immagini dei nanopilastri sui diamanti. (A) Imaging SEM dei nanopilastri di diamante fabbricati subito dopo l'incisione con ioni reattivi (RIE). La parte superiore del nanopilastro è ricoperta dall'idrogeno silsesquiossano (HSQ) per proteggere il centro NV. (B) Un singolo nanopillar a forma di cilindro trapezoidale per rilevare le sezioni cellulari aderito alla punta dell'AFM. Barre della scala, 10 micron (A); 400nm (B). Credito:progressi scientifici, doi:10.1126/sciadv.aau8038.
Nelle scienze della vita, la capacità di misurare la distribuzione delle biomolecole all'interno di una cellula in situ è un importante obiettivo investigativo. Tra una varietà di tecniche, gli scienziati hanno utilizzato l'imaging magnetico (MI) basato sul centro vacante di azoto (NV) nei diamanti come potente strumento nella ricerca biomolecolare. Però, l'imaging su nanoscala delle proteine intracellulari è rimasto finora una sfida. In un recente studio ora pubblicato in Progressi scientifici , Pengfei Wang e colleghi dei dipartimenti interdisciplinari di fisica, biomacromolecole, informazioni quantistiche e scienze della vita in Cina, utilizzato proteine ferritina per dimostrare la realizzazione MI di proteine endogene in una singola cellula, utilizzando il centro della vacanza di azoto (NV) come sensore. Hanno ripreso le ferritine intracellulari e gli organelli contenenti ferritina utilizzando l'MI e la microscopia elettronica correlativa per aprire la strada all'imaging magnetico (MI) su scala nanometrica delle proteine intracellulari.
L'aumento della risoluzione spaziale esistente dell'imaging biomedico è necessario per soddisfare le continue richieste nell'imaging medico, e quindi, tra una varietà di tecniche, l'imaging magnetico è di grande interesse al momento. La risonanza magnetica per immagini (MRI) è ampiamente utilizzata per quantificare la distribuzione degli spin nucleari, ma la risonanza magnetica convenzionale può raggiungere solo una risoluzione di 1 µm nell'imaging con spin nucleare, dove la risoluzione è limitata dalla sensibilità di rilevamento elettrico. Gli scienziati hanno sviluppato una serie di tecniche per rompere questa barriera di risoluzione, tra cui un dispositivo di interferenza quantistica superconduttore e microscopia a forza di risonanza magnetica. Tuttavia, questi rapporti richiedono un ambiente criogenico e un vuoto spinto per l'imaging, limitando l'implementazione sperimentale e la sua traduzione nella pratica clinica.
Un metodo di rilevamento quantistico sviluppato di recente, basato sul centro di vacanza dell'azoto nel diamante, ha spinto radicalmente i confini delle tecniche MI su scala nanometrica per rilevare molecole organiche e proteine in laboratorio. Gli scienziati hanno combinato il rilevamento quantistico con i centri NV e la microscopia a scansione di sonda per dimostrare la risonanza magnetica su scala nanometrica per lo spin di un singolo elettrone e il piccolo insieme di spin nucleare mentre utilizzano il centro NV come magnetometro biocompatibile per l'immagine non invasiva di particelle ferromagnetiche all'interno delle cellule su scala subcellulare (0,4 µm). Per esempio, la depolarizzazione del centro NV può essere utilizzata come magnetometro a banda larga per rilevare e misurare il rumore fluttuante da ioni metallici e spin nucleari. Però, tale imaging di singole proteine tramite MI su scala nanometrica non è stato finora riportato nella singola cellula.
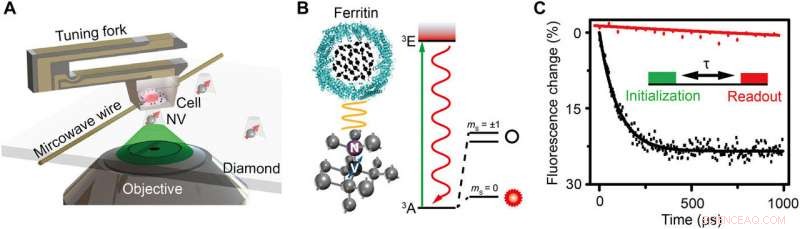
Schema dell'impianto e principio sperimentale. (A) Vista schematica del setup sperimentale. La cella incorporata nella resina è attaccata a un diapason e scansiona sopra il nanopilastro di diamante che contiene un centro NV poco profondo. Un filo di rame viene utilizzato per fornire l'impulso a microonde al centro NV. Un laser verde (532 nm) del microscopio confocale (CFM) viene utilizzato per affrontare, inizializzare, e leggere il centro NV. (B) A sinistra:reticolo cristallino e livello energetico del centro NV. Il centro NV è un difetto puntiforme costituito da un atomo di azoto sostitutivo e da un vuoto adiacente nel diamante. A destra:vista schematica di una ferritina. Le frecce nere indicano gli spin elettronici di Fe3+. (C) Dimostrazione sperimentale del rilevamento del rumore di spin con e senza ferritina sotto forma di decadimento della polarizzazione per lo stesso centro NV. L'inserto è la sequenza di impulsi per il rilevamento e l'imaging della ferritina. Un laser verde da 5 μs viene utilizzato per inizializzare lo stato di spin a ms =0, seguito da un tempo di evoluzione libera per accumulare il rumore magnetico, e infine lo stato di spin viene letto rilevando l'intensità della fluorescenza. La sequenza di impulsi viene ripetuta circa 105 volte per acquisire un buon rapporto segnale/rumore (SNR). Il tempo di rilassamento è fissato a 0,1 e 3,3 ms per decadimento esponenziale per il caso con e senza ferritina, rispettivamente, indicando un rumore di rotazione di 0,01 mT2. Credito:progressi scientifici, doi:10.1126/sciadv.aau8038.
Nel presente lavoro, Wang et al. hanno riportato due progressi tecnici per consentire MI su scala nanometrica di proteine intracellulari all'interno di una singola cellula. Per questo, hanno congelato la cella allo stato solido e l'hanno segmentata in modo intricato a forma di cubo, quindi lo ha posizionato su una sonda di scansione a diapason di un microscopio a forza atomica (AFM) per l'imaging, dove la sezione trasversale piatta della cella era esposta all'aria. Gli scienziati hanno utilizzato la configurazione di posizionamento del campione per consentire al sensore NV di essere posizionato entro 10 nm dalle proteine bersaglio e hanno utilizzato l'AFM per sopprimere la deriva termica durante il posizionamento del campione. Hanno quindi progettato nanocolonne trapezoidali a forma di cilindro su una superficie diamantata sfusa per l'acquisizione di immagini, accorciando tecnicamente il tempo di acquisizione dell'immagine di un ordine rispetto ai metodi precedenti. In questo studio, gli scienziati hanno utilizzato questa tecnica per condurre l'MI in situ del rumore fluttuante magnetico delle proteine della ferritina intracellulare (un biomarcatore delle riserve di ferro e della saturazione della transferrina nel corpo) all'interno della configurazione sperimentale.
La ferritina è un complesso proteico globulare con un diametro esterno di 12 nm, contenente una cavità di 8 nm di diametro che consente di immagazzinare fino a 4500 atomi di ferro all'interno della proteina. Il rumore magnetico degli ioni ferrici può essere rilevato a causa dei loro effetti sulla T 1 tempo di relax di un centro NV. In questo lavoro, Wang et al. ha confermato l'osservazione mediante misure di fluorescenza del decadimento dipendente dal tempo della popolazione dei centri NV (spin magnetico, m S =0 stato), in una superficie diamantata ricoperta di ferritine. Inoltre, gli scienziati hanno rilevato il rumore magnetico con metodi privi di etichette utilizzando il centro NV tramite microscopia elettronica a trasmissione (TEM). The work allowed the development of a correlated MI and TEM scheme to obtain and verify the first nanoscale MI of a protein in situ.
The scientists used the hepatic carcinoma cell line (HepG2) for the experiments and studied iron metabolism by treating the cells with ferric ammonium citrate (FAC), which significantly increased the amount of intracellular ferritin. They verified this using confocal microscopy (CFM), western blotting and TEM techniques at first. The results showed the primary localization of ferritins in the intracellular puncta around the nucleus, among the cytoplasm. The scientists used bulk electron paramagnetic resonance (EPR) spectroscopy to confirm the paramagnetic properties of ferritin in the FAC-treated HepG2 cells and mass spectroscopy to measure the interference due to other paramagnetic metal ions.
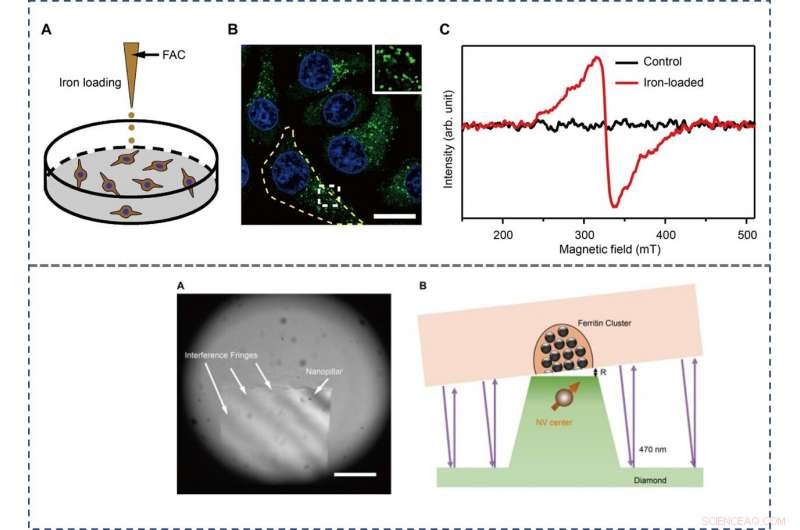
TOP - The preparation and characterization of ferritin-rich HepG2 cell samples. (A) Schematic view of the treatment to cultured cells. Following iron loading or no treatment, the HepG2 cells were examined for fluorescence images and EPR spectra, rispettivamente. For the MI and TEM imaging, cell samples were treated through high-pressure freezing, freeze substitution, and sectioning. (B) Representative confocal microscopy (CFM) image of ferritin structures (green) in iron-loaded HepG2 cells. The ferritin proteins were immunostained by anti-ferritin light chain antibody. The nuclei are indicated by 4′, 6-diamidino-2-phenylindole (DAPI) in the blue channel. Inset displays magnified ferritin structures. The yellow dashed line outlines the contour of a cell. Barra della scala, 20 μm. (C) EPR spectra of control and iron-loaded HepG2 cells at T =300 K. BOTTOM - Adjusting the distance between the NV center and the cell section. (A) Interference fringes between the cell cube and the diamond surface. Barra della scala, 20 μm. (B) The geometric relation and the gap R between cell samples and diamond-pillars for MI. The top surface diameter of the nanopillar is 400 nm. Credit:Science Advances, doi:10.1126/sciadv.aau8038.
Wang et al. then used ultrafast, high-pressure freezing to immobilize all intracellular components of the Fe-loaded cells. The process stabilized the intracellular structures and molecules by minimizing Brownian motion in cells, which typically contributes to random motion of proteins up to 100 nm in vivo. To image the samples, they embedded and polymerized the frozen cells in LR White medium, followed by gluing the embedded cell sample to the AFM tuning fork with a few cells at the tip. Using a diamond knife, the scientists then sectioned the tip surface to nanometer flatness to examine the cuboid cell section under AFM. They acquired MI images of ferritins by scanning the cell cube along the diamond nanopillars and simultaneously measured NV spin repolarization rate using the "leapfrog" scanning mode of the microscope as detailed previously.
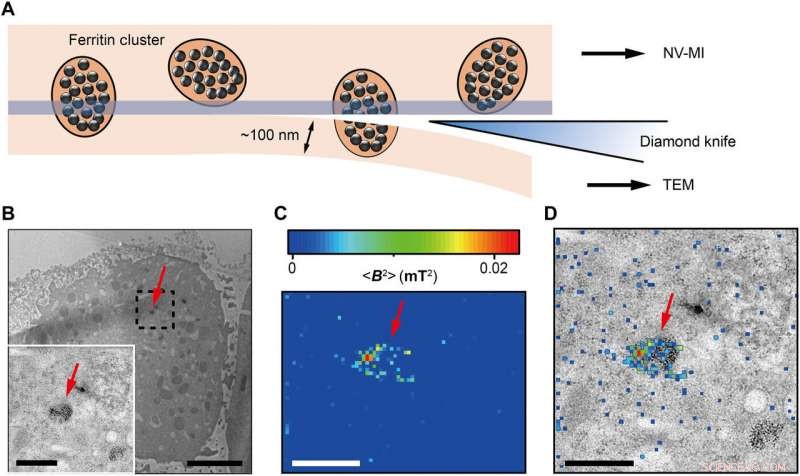
Correlative MI and TEM images. (A) Schematic view of sectioning for correlative MI and TEM imaging. The last section and the remaining cube were transferred for TEM imaging and MI scanning, rispettivamente. The sectioning resulted in some split ferritin clusters that could be imaged under both microscopes. A transparent blue strip of ~10 nm indicates the imaging depth of the MI, while in the TEM, the imaging depth is ~100 nm. (B) Distribution of ferritins from the last ultrathin section under TEM. Inset:Magnified figure of the part in black dashed box. (C) MI result of the remaining cell cube. The pixel size is 43 nm. (D) The merged MI and TEM micrograph shows ferritins in a membrane-bound organelle. The red arrows in (B) to (D) indicate the same ferritin cluster. Scale bars, 5 μm (B) and 1 μm [B (inset), C, and D]. Credit:Science Advances, doi:10.1126/sciadv.aau8038.
The scientists measured fluorescence decay at a fixed free evolution time of 50 microseconds (τ =50 μs) to reveal the degree of NV sensor spin polarization, which correlated with the amount of ferritin in the sensing volume. They observed the appearance of some clusters via both TEM and MI images, although some details were not observed in MI, the results confirmed that spin noise from intracellular ferritin contributed to depolarize the NV center. In order to obtain details of the ferritin clusters at higher resolution, the scientists minimized the pixel size to 8.3 nm and acquired MI of high resolution of the proteins as expected.
In questo modo, Wang et al. explored the sensitivity of NV centers as an appropriate sensor for biological imaging applications at the level of the single molecule. They used the technique as a sensor in the experimental setup to obtain the first MI of a protein at a resolution of 10 nm in situ. The scientists aim to improve the stability and sensitivity of the technique to speed up the scanning process and image a larger area of interest in the cell and locate ferritin beyond the nucleus in association with additional organelles.
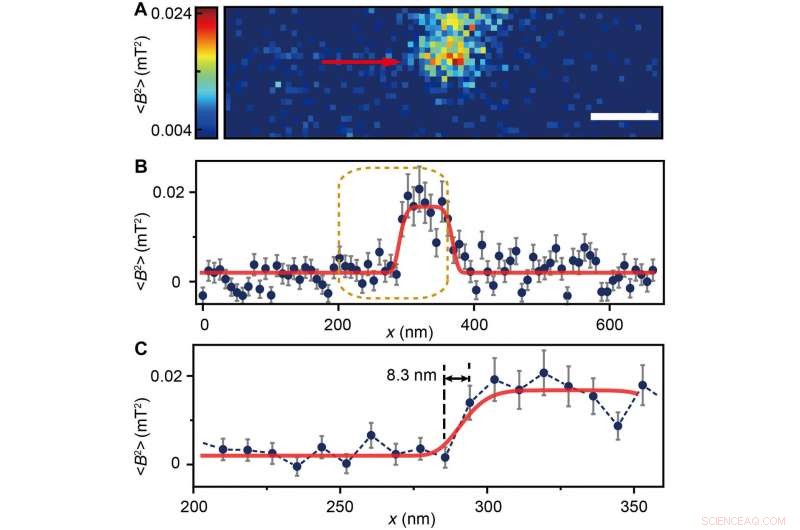
(A) Ferritin cluster imaged by the NV sensor with 80 × 24 pixels and a pixel size of 8.3 nm. Barra della scala, 100 nm. (B) Trace data of the scanning line in (A) directed by the red arrow. The platform indicates the ferritin cluster. The red curve fitted by a plateau function serves as a guide to the eye. (C) Magnified figure of the gold dashed box in (B). The sharp transition indicated by the red arrow around x =283 nm shows the scanning from the blank area to the area with ferritins. Credit:Science Advances, doi:10.1126/sciadv.aau8038.
The work will contribute to clinical diagnostics to determine biomarker-based iron storage and release in cells. This will include studies on the regulatory mechanisms of iron metabolism during the progression of hemochromatosis, anemia, liver cirrhosis and Alzheimer's disease. Wang et al. propose to extend the approach in situ to other cellular components with paramagnetic signals, including magnetic molecules, metalloproteins and special spin-labelled proteins. The scientists envision that further studies will explore additional targets suitable for high-resolution MI and correlated TEM imaging techniques, with optical microscopy detection incorporated to the experimental setup to extend the work and determine protein nuclear spin MRI as well as perform three-dimensional cell tomography.
© 2019 Scienza X Rete