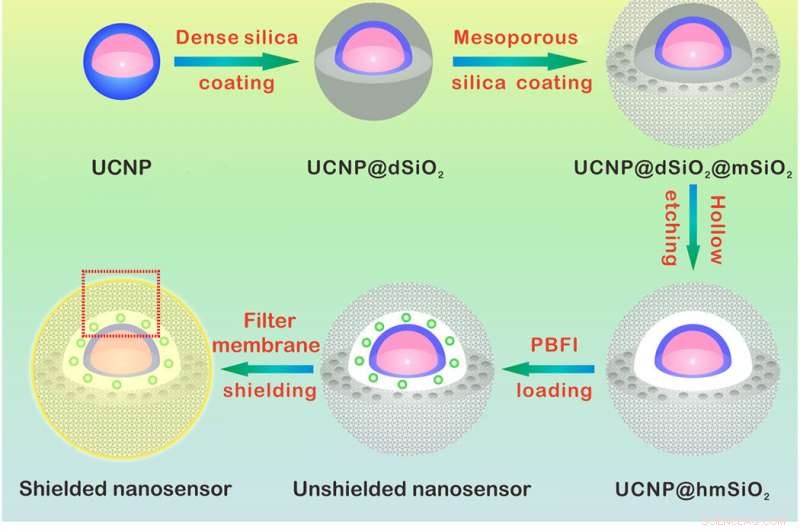
Meccanismo di progettazione e rilevamento del nanosensore K+. (A) Illustrazione schematica per la sintesi del nanosensore. Il nucleo NaYF4:Yb/Tm@NaYF4:Yb/Nd (UCNP) è stato sintetizzato e rivestito con uno strato di silice denso e un successivo guscio di silice mesoporosa. L'incisione del denso strato di silice forma una cavità cava che consente il caricamento di PBFI. Il nanosensore è stato infine rivestito con la membrana filtrante K+-selettiva. (B) Schemi che mostrano una vista ingrandita del nanosensore [dal riquadro rosso tratteggiato in (A)] e il suo meccanismo di rilevamento K+. Lo strato di membrana filtrante consente solo al K+ di diffondere dentro e fuori il nanosensore, escludendo così l'interferenza di altri cationi. Una volta diffuso nel nanosensore, K+ si legherà immediatamente a PBFI. Dopo l'irradiazione NIR, la luce UV convertita dagli UCNP eccita PBFI, che porta all'emissione di PBFI legato al K+. Credito:progressi scientifici, doi:10.1126/sciadv.aax9757
I ricercatori hanno sviluppato una serie di ioni potassio (K + ) sonde per rilevare K . fluttuante + concentrazioni durante una serie di processi biologici. Però, tali sonde non sono sufficientemente sensibili per rilevare le fluttuazioni fisiologiche negli animali viventi e non è facile monitorare i tessuti profondi con eccitazioni a lunghezza d'onda corta finora in uso. In un nuovo rapporto, Jianan Liu e un team di ricercatori in neuroscienze, chimica, e ingegneria molecolare in Cina, descrivere un nanosensore altamente sensibile e selettivo per il vicino infrarosso (NIR) K + imaging ionico nelle cellule viventi e negli animali. Il team ha costruito il nanosensore incapsulando nanoparticelle di conversione (UCNP) e un indicatore commerciale di ioni di potassio nella cavità cava di nanoparticelle di silice mesoporosa e le ha rivestite con un K + membrana filtrante selettiva. La membrana ha assorbito K + dal mezzo e filtrato via eventuali cationi interferenti. Nel suo meccanismo d'azione, Gli UCNP hanno convertito il NIR in luce ultravioletta (UV) per eccitare l'indicatore di ioni potassio e rilevare le concentrazioni fluttuanti di ioni potassio nelle cellule coltivate e in modelli animali di malattia, inclusi topi e larve di zebrafish. I risultati sono ora pubblicati su Progressi scientifici .
Il più abbondante catione intracellulare potassio (K + ) è estremamente cruciale in una varietà di processi biologici compresa la trasmissione neurale, battito cardiaco, contrazione muscolare e funzione renale. Variazioni del K . intracellulare o extracellulare + concentrazione (di seguito indicato come [K + ]) suggeriscono funzioni fisiologiche anormali, inclusa la disfunzione cardiaca, cancro, e diabete. Di conseguenza, i ricercatori sono desiderosi di sviluppare strategie efficaci per monitorare le dinamiche di [K + ] fluttuazioni, in particolare con l'imaging ottico diretto.
La maggior parte delle sonde esistenti non è sensibile a K + rilevamento in condizioni fisiologiche e non è in grado di differenziare le fluttuazioni tra [K + ] e il relativo ione sodio ([Na + ]) durante il trasporto transmembrana nel Na + /K + pompe. Mentre l'imaging a vita in fluorescenza può distinguere K + e Na + in soluzione acquosa, il metodo richiede strumenti specializzati. La maggior parte K + i sensori vengono attivati anche con luce a lunghezza d'onda corta, compresa la luce ultravioletta (UV) o visibile, portando a una dispersione significativa ea una profondità di penetrazione limitata durante l'esame dei tessuti viventi. In contrasto, la tecnica di imaging del vicino infrarosso (NIR) proposta offrirà vantaggi unici durante l'imaging dei tessuti profondi come alternativa plausibile.
Caratterizzazione strutturale del nanosensore K+. (da A a C) Immagini in campo scuro anulare ad alto angolo di UCNP@dSiO2 (A), UCNP@dSiO2@mSiO2 (B), e UCNP@hmSiO2 (C). (D) Immagine al microscopio elettronico a scansione (SEM) del nanosensore schermato. (E) Immagine SEM del nanosensore schermato immerso in una soluzione acquosa contenente 150 mM Na+, 150 mM K+, 2 mm Ca2+, 2 mm Mg2+, 50 μM Fe2+, 2 mm Zn2+, 50 μM Mn2+, e 50 μM Cu2+. (F) I profili di scansione della linea elementare EDS lungo la linea bianca in (E) rivelano che solo i segnali K+ sono presenti nei mesopori e nelle cavità cave dei nanosensori schermati. Credito:progressi scientifici, doi:10.1126/sciadv.aax9757 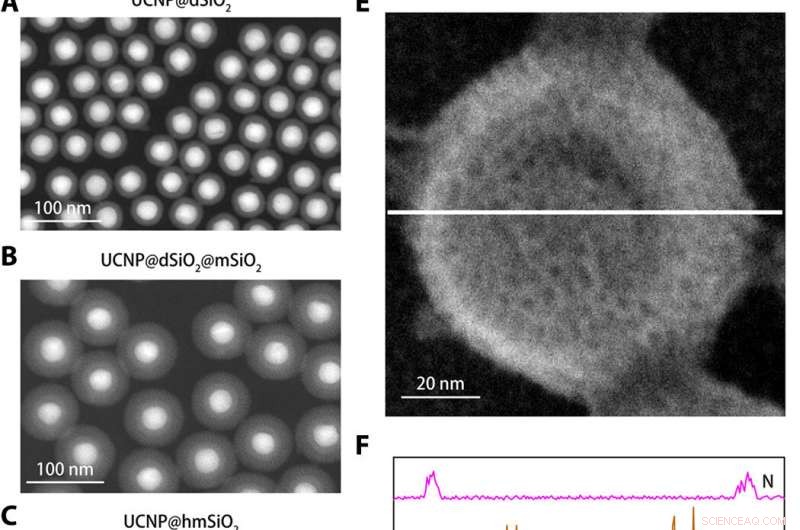
Per progettare il nanosensore, Liu et al. nanoparticelle di upconversion incapsulate (UCNP) e un K . commerciale + indicatore:benzofurano isoftalato (PBFI) che lega il potassio nel nucleo delle nanoparticelle di silice mesoporosa (MSN). Gli UCNP sono stati in grado di convertire la luce NIR in luce UV ed eccitare l'accettore del K + indicatore attraverso il trasferimento di energia di risonanza di luminescenza. Hanno schermato la superficie esterna delle nanoparticelle di silice con un sottile strato di K + membrana filtrante selettiva con micropori creati da ossigeno carbonilico per specificità. L'assetto ha favorito il trasferimento a titolo gratuito di K + attraverso il poro della membrana, impedendo la diffusione di altri cationi biologicamente rilevanti. La tecnica ha permesso loro di rilevare lievi fluttuazioni in [K + ] nella soluzione. Il team ha utilizzato la microscopia elettronica a trasmissione (TEM) per osservare la struttura ben controllata e l'aspetto delle nanoparticelle durante ogni fase della costruzione del nanosensore. La diffusione dinamica della luce ha confermato la presenza di una membrana filtrante sulla superficie del nanosensore schermato.
Imaging dell'efflusso di K+ nelle cellule HEK 293. (A) Schemi che mostrano il rilevamento dell'efflusso di K + da parte di un nanosensore coniugato con streptavidina, che è legato a una cellula modificata con biotina. (B) Immagini di microscopia confocale che mostrano la fluorescenza (da 400 a 500 nm e da 500 a 600 nm) di cellule HEK 293 etichettate con nanosensori in diversi momenti dopo il trattamento con lo stimolatore di efflusso K + (una miscela di 5 μM di nigericina, 5 μM di bumetanide, e 10 μM ouabain). (C) Andamento temporale delle variazioni di fluorescenza del nanosensore e dipendenza dal tempo calcolata della velocità di efflusso del K+ dopo il trattamento con lo stimolatore dell'efflusso del K+. (D) Fluttuazioni di fluorescenza dipendenti dal tempo di cellule HEK 293 etichettate con nanosensori schermate dopo trattamenti con diverse concentrazioni (20, 40, 60, 80, e 100%) di stimolatore di efflusso di K+. I risultati di cinque esperimenti indipendenti sono stati riassunti come media ± SEM in (C) e (D). Credito:progressi scientifici, doi:10.1126/sciadv.aax9757 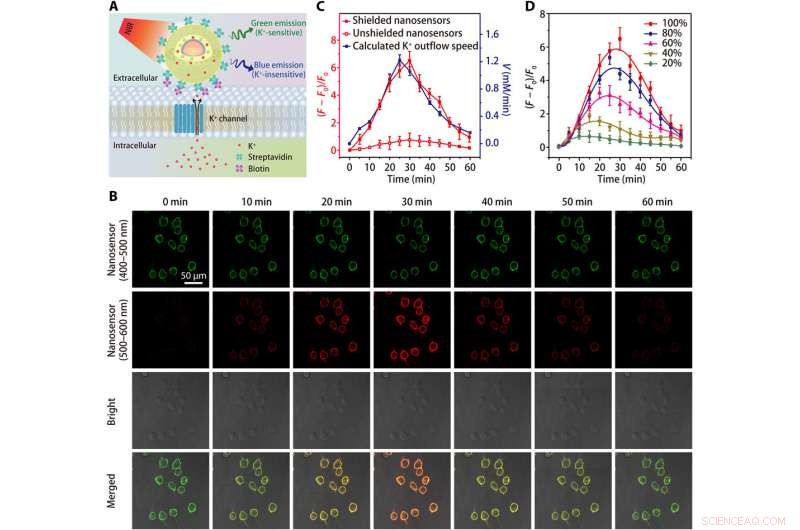
Il team ha testato la maggiore sensibilità del nanosensore schermato in un intervallo fisiologico (da 0 a 150 mM) e ha mostrato un aumento di 12 volte dell'intensità della fluorescenza rispetto ai nanosensori non schermati. il K + le sonde dovevano mostrare un'elevata selettività nei confronti del Na + , che Liu et al. verificato utilizzando il nanosensore schermato rilevando rapidamente la sensibilità di fluorescenza coerente alla fluttuazione di [K + ], pur rimanendo inalterato aumentando [Na + ].
Poiché le cellule viventi si affidano all'adenosina trifosfatasi sodio-potassio (Na + /K + pompa) per mantenere una pendenza [K + ] gradiente attraverso la loro membrana plasmatica, il processo è parzialmente responsabile del dispendio energetico della cellula. Difetti nel metabolismo energetico cellulare possono portare a una perdita del [K + ] gradiente, dando origine a extracellulare [K + ] noto come [K + ] 0, che gli scienziati hanno monitorato per ottenere un prezioso indicatore della vitalità e della crescita cellulare. Successivamente, hanno aumentato la specificità del nanosensore per rilevare la morte cellulare oi tassi di proliferazione innestando glicole polietilenico (PEG) sulla superficie dei nanosensori in un terreno di coltura contenente la linea cellulare 293 di rene embrionale umano. Hanno quindi ottimizzato il protocollo ancorando un gran numero di nanosensori sulle membrane cellulari utilizzando nanosensori coniugati con streptavidina a cellule modificate con biotina. I risultati hanno evidenziato una migliore sensibilità dei nanosensori schermati per monitorare continuamente il K + efflusso.
Risultati di imaging K+ del cervello di topo trattato con nanosensori schermati all'inizio della diffusione della depressione mediante l'attivazione di KCl. Il video integrale è otto volte più veloce della velocità reale. Credito:progressi scientifici, doi:10.1126/sciadv.aax9757 
Il team ha quindi applicato il nanosensore schermato per studiare la depressione a diffusione corticale (CSD) nel cervello del topo come propagazione ondulatoria dell'attività neurale. Il processo in genere comporta un rilascio di propagazione lenta di K + nella superficie corticale e potrebbe essere attivato nel cervello del topo tramite l'incubazione di cloruro di potassio (KCl). Gli scienziati hanno monitorato contemporaneamente il potenziale del campo locale e il segnale ottico attraverso la finestra cranica chirurgica e hanno osservato un'ondata di aumento [K + ] 0 propagarsi gradualmente attraverso la corteccia dopo la stimolazione. Liu et al. non ha osservato un'onda nei topi iniettati con nanosensori non schermati, indicando l'importanza del filtro esterno per una migliore sensibilità del nanosensore. La velocità dell'onda registrata non variava significativamente dai valori ottenuti utilizzando la risonanza magnetica (MRI) dipendente dal livello di ossigeno nel sangue in pazienti con aura emicranica.
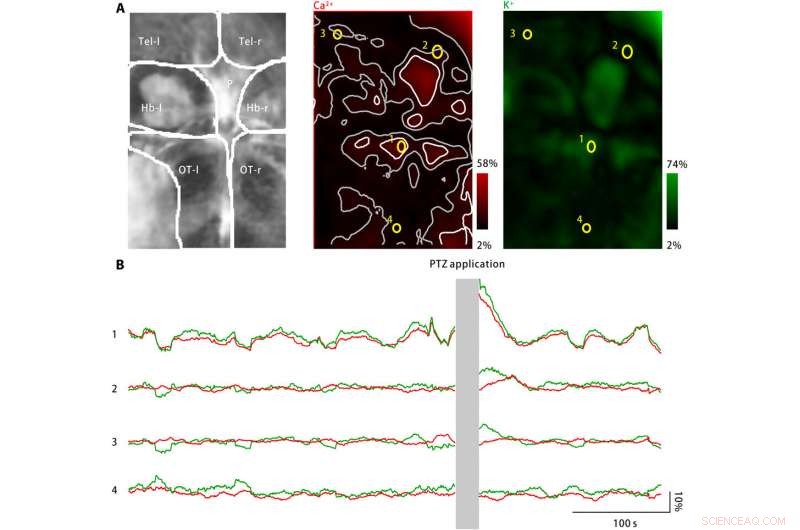
Potassio extracellulare scoppiato nel cervello di zebrafish larvale dopo il trattamento con PTZ. (A) Il trattamento con PTZ ha indotto aumenti sia dell'attività neuronale del calcio (al centro) che della concentrazione extracellulare di potassio (a destra). A sinistra:le aree cerebrali rappresentate includono il telencefalo sinistro e destro (Tel-l e Tel-r, rispettivamente), le habenule sinistra e destra (Hb-l e Hb-r, rispettivamente), il corpo pineale (P), e il tecta ottico sinistro e destro (OT-l e OT-r, rispettivamente). Medio:l'attività neuronale del calcio è stata monitorata utilizzando un indicatore del calcio espresso geneticamente, jRGECO1a. L'ampiezza della risposta misurata è codificata in rosso e mappata di nuovo alla regione del cervello immaginata. I punti di attività sparsi sono contrassegnati in bianco, e le zone limitrofe sono contrassegnate in grigio. Sono selezionate quattro ROI (gialle). A destra:la concentrazione di potassio extracellulare è stata monitorata utilizzando il nanosensore di potassio. L'ampiezza della risposta misurata è codificata in verde e mappata di nuovo alla regione del cervello immaginata. (B) L'attività neuronale del calcio (rosso) e le concentrazioni extracellulari di potassio osservate per le quattro ROI rappresentative sono contrassegnate in (A). Dopo l'applicazione PTZ, sia l'attività neuronale del calcio che la concentrazione extracellulare di potassio sono aumentate in diversi punti di attività, compreso il corpo pineale e il tecta ottico anteriore, come rappresentato da ROI1. Nelle zone limitrofe ai luoghi di attività, il cambiamento dell'attività neuronale del calcio è assente o minimo, mentre la concentrazione extracellulare di potassio continua ad aumentare (ROI2 e ROI3). Però, nell'area lontana dai punti di attività (ROI4), né l'attività neuronale del calcio né la concentrazione extracellulare di potassio sono aumentate. Credito:progressi scientifici, doi:10.1126/sciadv.aax9757
Per estendere le applicazioni del nanosensore, Liu et al. monitorati i livelli di calcio neuronale e le concentrazioni di potassio extracellulare utilizzando larve di zebrafish. Mentre un grande aumento della concentrazione extracellulare di potassio può causare un'intensa attivazione neuronale per causare CSD ed epilessia, non esistono prove dirette per mostrare cambiamenti nel potassio extracellulare durante la malattia. Il team ha quindi progettato un modello di malattia utilizzando larve di pesce zebra per aumentare le concentrazioni extracellulari di potassio e ha osservato l'attivazione neuronale caratteristica della malattia in specifiche regioni del cervello.
In questo modo, Jianan Liu e colleghi hanno progettato un nanosensore agli ioni di potassio con una sensibilità e una selettività estremamente elevate. Il rivestimento esterno di una membrana filtrante selettiva ha migliorato la selettività, sensibilità, e cinetica del dispositivo per rapido e quantitativo [K + ] rilevamento in cellule viventi e cervelli intatti. Il nanosensore schermato avrà ampie applicazioni nella ricerca sul cervello per migliorare la comprensione di anormali [K + ] malattie correlate. Il metodo insieme all'endoscopio a fibra ottica e alla fotometria consentirà l'imaging del potassio in tempo reale negli animali che si muovono liberamente.
© 2020 Scienza X Rete