Credito:Unsplash/CC0 dominio pubblico
Nel corpo umano, le proteine a volte si trovano in aggregati fibrillari chiamati amiloidi. Sebbene sia noto che alcuni amiloidi hanno una funzione biologica, la formazione di amiloide è spesso associata a patologie, comprese le malattie di Alzheimer e di Parkinson. Comprendere esattamente come si formano le fibrille amiloidi è fondamentale per ottenere informazioni sullo sviluppo di tali malattie e per avanzare con gli approcci terapeutici.
Ora, Takahiro Watanabe-Nakayama dell'Università di Kanazawa, Kenjiro Ono della Showa University, e colleghi hanno studiato il processo di formazione di particolari fibrille amiloidi utilizzando una tecnica che consente la visualizzazione della crescita nel tempo. Gli scienziati hanno esaminato in modo specifico l'effetto della semina incrociata ("miscelazione") di diverse proteine che formano aggregati, e trovarono variazioni nei tassi di allungamento e nelle strutture delle fibrille.
I ricercatori hanno studiato l'alfa-sinucleina, una proteina abbondante nel cervello umano. Hanno esaminato cosa è successo quando hanno lasciato che le molecole di alfa-sinucleina di tipo selvatico - il naturale, variante più abbondante:forma aggregati, e anche come l'aggregazione è diversa quando si introducono varianti mutanti (seminazioni incrociate) associate alla malattia di Parkinson. Inoltre, gli scienziati hanno esaminato l'influenza del livello di pH del microambiente in cui avviene la crescita delle fibrille.
Mediante microscopia a forza atomica ad alta velocità (HS-AFM), Watanabe-Nakayama, Ono e colleghi hanno potuto registrare l'aggregazione di fibrille con una risoluzione nanometrica e un'alta velocità video per vari casi. Primo, gli scienziati hanno esaminato la crescita di tipi di singole varianti (auto-semina). Hanno scoperto che i mutanti producono più aggregati, o che si sono aggregati più velocemente a pH neutro rispetto alle varianti wild-type. Un'altra osservazione è stata che l'allungamento era più veloce a pH più basso (5,8, cioè acido) che a pH più alto (7,4, cioè di base).
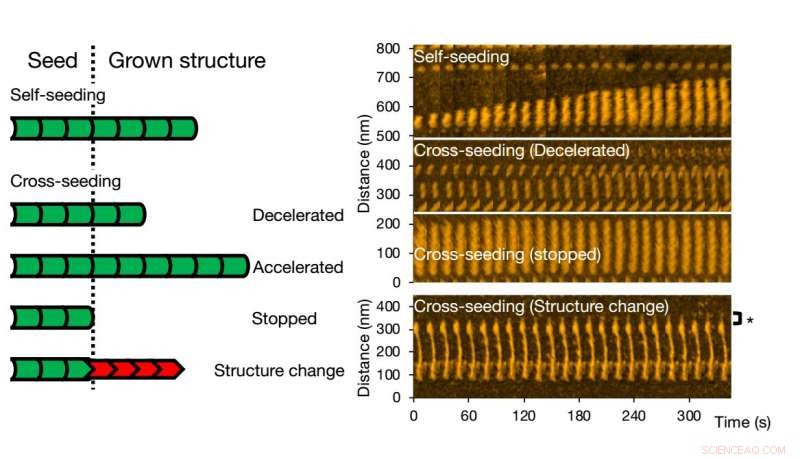
La microscopia a forza atomica ad alta velocità consente di visualizzare e analizzare la formazione di fibrille di varianti di una singola proteina. Credito:Università di Kanazawa
Per la semina incrociata, possono verificarsi diversi scenari. La crescita delle fibrille può essere accelerata o rallentata, o addirittura fermato. La morfologia del seme originario può essere preservata, ma accade anche che la struttura della fibrilla risultante sia diversa:le forme strutturali tipiche sono "diritte" o "a spirale". I ricercatori hanno verificato che la struttura e la dinamica delle fibrille osservate con HS-AFM corrispondono ai processi in soluzione mediante esperimenti di fluorescenza; conclusioni simili sono state ottenute.
Le scoperte di Watanabe-Nakayama, Ono e colleghi sono importanti per una migliore comprensione delle malattie legate all'amiloide. Citando i ricercatori:"La semina incrociata combinata con variazioni nei tassi di allungamento ha l'effetto di aumentare la diversità strutturale degli assemblaggi risultanti. Questa diversità può riflettersi in distinti effetti neurotossici per vari assemblaggi [proteici]".