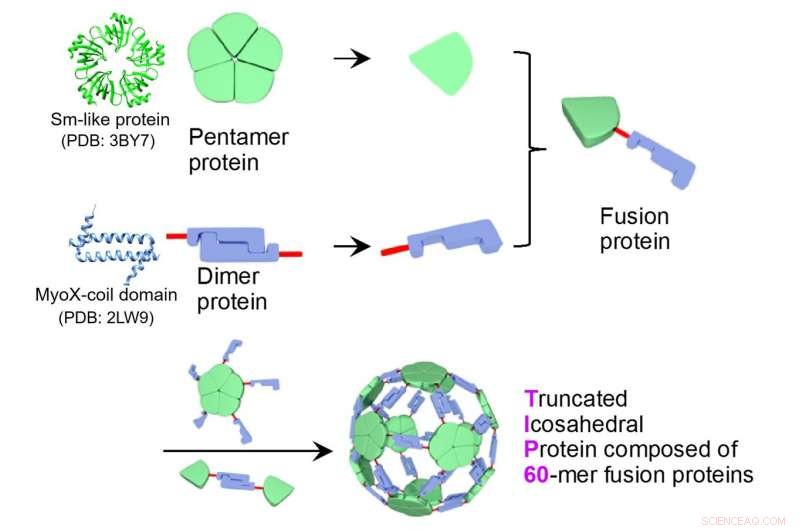
Sessanta proteine di fusione di una proteina pentamerica Sm-like (ID PDB:3BY7) e un dominio MyoX-coil dimerico (ID PDB:2LW9) si autoassemblano in un complesso di nanoparticelle proteiche, TIP60 (proteina icosaedrica troncata composta da proteine di fusione 60-mer). Credito:riprodotto dalla struttura porosa icosaedrica 60-merica della nanoparticella proteica supramolecolare progettata TIP60, Ryoichi Arai et al., chimica. comune ., 2021, con il permesso della Royal Society of Chemistry.
Le nanoparticelle e le nanogabbie sono materiali attraenti che possono essere applicati in agenti coloranti, catalizzatori, e consegna del farmaco. Per l'uso nel mondo reale, è necessario produrre un gran numero di nanoparticelle di dimensioni e forma uniformi, ma finora, i metodi di formazione delle nanoparticelle che utilizzano metalli sono stati ampiamente studiati, e sono state realizzate la formazione di nanoparticelle con una certa forma e dimensione. Però, non è facile creare un gruppo di nanoparticelle uniformi con la stessa struttura a livello atomico.
Un gruppo di ricerca congiunto guidato dal Professore Associato Ryoichi Arai (Istituto di Scienze Biomediche e Facoltà di Scienze e Tecnologie Tessili, Shinshu University) e Assistant Professor Norifumi Kawakami (Facoltà di Scienze e Tecnologie, Keio University) ha sviluppato una nanoparticella proteica supramolecolare uniforme e utile autoassemblata simmetricamente da proteine di fusione di un dominio proteico pentamerica e un dominio proteico dimerico. È possibile modificare la funzionalità mediante mutagenesi sito-specifica o modificazione chimica. Questa nanoparticella proteica progettata con un diametro di circa 22 nm è stata denominata TIP60 (proteina icosaedrica troncata composta da proteine di fusione 60-mer) perché è formata da proteine di fusione artificiale 60-meric autoassemblanti a forma di pallone da calcio.
In questo studio, il gruppo di ricerca congiunto ha risolto la struttura tridimensionale dettagliata del TIP60 utilizzando la microscopia crioelettronica a particella singola. Una grande quantità di TIP60 è stata espressa in E. coli, e un campione purificato è stato osservato presso la struttura del microscopio crioelettronico gestita dal laboratorio del Prof. Masahide Kikkawa presso l'Università di Tokyo. Eseguendo l'analisi di singole particelle sulla base dei dati di immagine ottenuti, è stata ricostruita una mappa tridimensionale con una risoluzione di 3,3 . È stato rivelato che TIP60 forma nanoparticelle sferiche cave come progettato e ha una struttura icosaedrica di 60 merici con 20 pori triangolari con un bordo di circa 4 nm ciascuno. Inoltre, il gruppo ha chiarito in dettaglio la caratteristica struttura tridimensionale, come il linker che collega il dominio di formazione del pentamero e il dominio di formazione del dimero composto da un'α-elica.
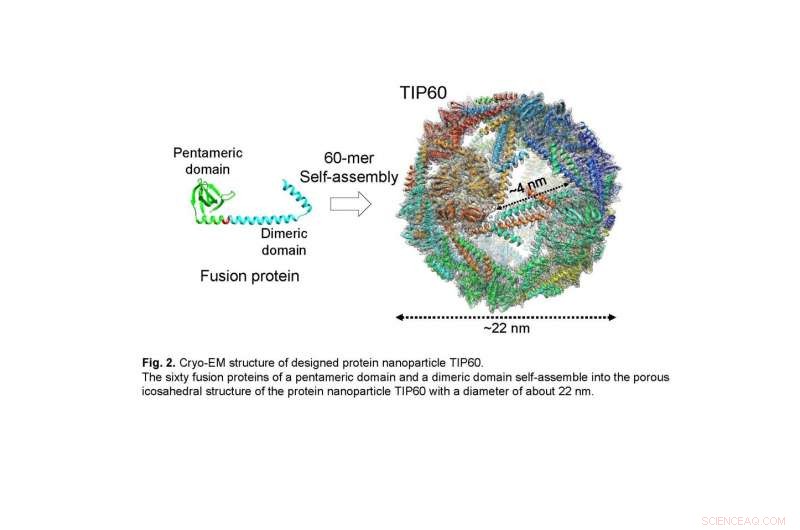
Le sessanta proteine di fusione di un dominio pentamerica e di un dominio dimerico si autoassemblano nella struttura porosa icosaedrica della nanoparticella proteica TIP60 con un diametro di circa 22 nm. Credito:Ryoichi Arai, Università di Shinshu
Quando un composto a piccola molecola viene aggiunto dopo aver modificato chimicamente solo la superficie esterna di TIP60 con un composto ad alto peso molecolare, il composto a piccola molecola entra nella cavità interna e si modifica chimicamente nella superficie interna. In altre parole, si è riscontrato che la struttura porosa di TIP60 funge da filtro per dimensione molecolare, e le superfici esterna ed interna di TIP60 possono essere modificate chimicamente con diverse molecole di diverse dimensioni.
Nel futuro, il gruppo utilizzerà nanoparticelle proteiche progettate artificialmente avanzando la progettazione e la modifica funzionale di varianti site-specific basate sulla struttura tridimensionale di TIP60 chiarita in questo studio. Si prevede che porti allo sviluppo e alle applicazioni nei campi delle nanobiotecnologie e dei nanomateriali, come l'uso come nanocapsula per un sistema di somministrazione di farmaci.
La ricerca è stata pubblicata su Comunicazioni chimiche .