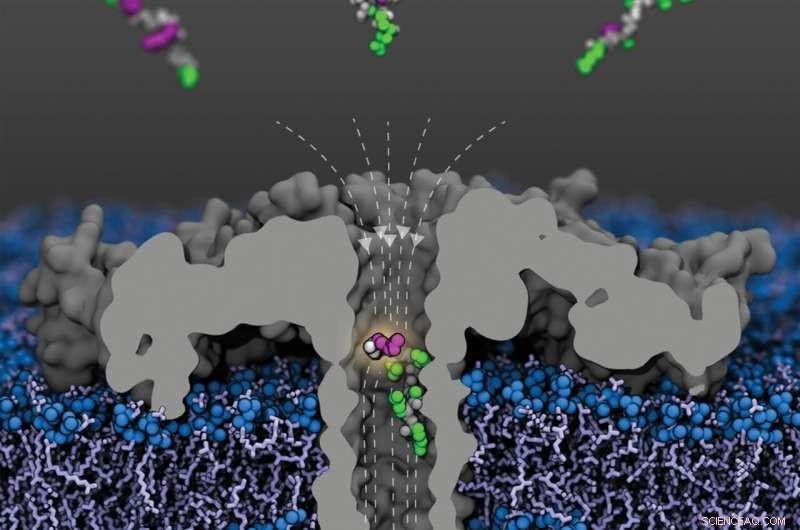
Vista aperta del poro dell'aerolisina modificato (R220S) (grigio) con linee di campo (tratteggiate) in una membrana lipidica. Frammenti di proteina istonica umana 4 acetilata a vari residui di lisina arrivano dal compartimento superiore; un frammento acetilato alla lisina-8 è mostrato all'interno del poro. Le spine peptidiche sono mostrate in grigio, le catene laterali non modificate in verde e le lisine acetilate in viola. Credito:Sarthak Kumar, Università dell'Illinois a Urbana-Champaign
I cambiamenti noti come modificazioni epigenetiche svolgono un ruolo importante nello sviluppo del cancro. Essere in grado di analizzarli in modo rapido e affidabile potrebbe contribuire in modo significativo all'ulteriore sviluppo della terapia personalizzata. Un gruppo di ricerca dell'Istituto di Fisiologia dell'Università di Friburgo è ora riuscito a caratterizzare i cambiamenti chimici nelle proteine tipiche delle modificazioni epigenetiche mediante l'analisi dei nanopori. I ricercatori hanno pubblicato i risultati della loro ricerca nel Journal of the American Chemical Society (JACS ).
Negli ultimi anni, i nanopori sono diventati uno strumento ampiamente applicabile per l'analisi delle molecole. Grazie alle loro proprietà speciali, consentono di analizzare la struttura delle molecole in frazioni di secondo:poiché le proteine disposte in modo cilindrico, i nanopori formano minuscoli canali di soli pochi milionesimi di millimetro (nanometri) di diametro che possono essere incorporati nelle biomembrane.
"Per gli esperimenti, applichiamo una tensione costante attraverso la membrana in modo che gli ioni del mezzo circostante fluiscano attraverso i pori. Questo crea una corrente elettrica costante e misurabile con precisione", spiega il Prof. Dr. Jan C. Behrends della Facoltà di Medicina presso l'Università di Friburgo, nel cui laboratorio si sono svolti gli esperimenti ora pubblicati. Tuttavia, quando una molecola migra nel poro, la corrente viene bloccata:più grande è la molecola, più fortemente viene bloccata.
Una proteina sotto i riflettori della ricerca:H4
Nel contesto degli esperimenti ora pubblicati, gli scienziati di Friburgo si sono dedicati allo studio della cosiddetta proteina istonica H4. Questa proteina è saldamente associata al DNA in tutte le cellule con un nucleo ed è uno dei bersagli meglio studiati delle modificazioni epigenetiche. Una regione all'estremità N-terminale della proteina è particolarmente interessata da queste modificazioni.
"La sequenza proteica contiene più volte l'aminoacido lisina", spiega Behrends. Gruppi acetilici o metilici, ad esempio, possono essere attaccati a queste lisine, che sono designate K8, K12 e K16 in base alla loro posizione nella catena proteica, come parte di modificazioni epigenetiche. Quale modificazione chimica avviene in corrispondenza di quale posizione della lisina è sicuramente di importanza medica, come sottolinea il fisiologo di Friburgo. "L'acetilazione a K16, ad esempio, è importante per lo sviluppo umano, mentre la metilazione a K12 svolge un ruolo nello sviluppo di alcuni tumori della prostata e dei polmoni, secondo gli ultimi risultati del Medical Center—Università di Friburgo".
Rilevamento delle modifiche con l'aiuto di un nanoporo
Nei loro esperimenti, Behrends e il suo team sono stati ora in grado di distinguere chiaramente frammenti di H4 con o senza acetilazione, nonché frammenti con una, due o tre acetilazioni. Inoltre, sono riusciti a dimostrare che il nanoporo utilizzato era anche sensibile al sito di acetilazione:frammenti di istone con un gruppo acetilico a K8 bloccavano la corrente attraverso i pori più fortemente di quelli acetilati a K12, e questi a loro volta più fortemente di quelli con un'acetilazione K16.
"Questo tipo di sensibilità è sorprendente in quanto questi frammenti sono identici in termini di massa e volume totale", afferma Behrends. Pertanto, la corrente dei pori sembra essere sensibile non solo alle dimensioni, ma anche alla forma della molecola. Era ugualmente facile distinguere tra le diverse varianti di frammenti di istoni doppiamente acetilati - K8 e K12, K8 e K16 e K12 e K16 - di nuovo, nonostante la massa identica. I frammenti di H4 metilati in misura diversa e in diverse posizioni hanno anche bloccato la corrente attraverso i pori in misura diversa, sebbene non così chiaramente come le varianti acetilate.
"Siamo stati in grado di dimostrare per la prima volta attraverso i nostri esperimenti che l'analisi dei nanopori ci consente di distinguere le molecole non solo dalle loro dimensioni, ma anche dalla loro forma", afferma il leader dello studio Behrends. Simulazioni di dinamica molecolare condotte dal gruppo di ricerca guidato da Aleksei Aksimentiev dell'Università dell'Illinois negli Stati Uniti, anch'esso coinvolto nello studio, mostrano che un campo elettrico altamente disomogeneo all'interno dei pori gioca un ruolo chiave per questo effetto.
Visione futura:diagnostica medica ottimizzata
Mentre il sequenziamento del DNA utilizzando i nanopori è già stabilito e commercializzato, lo sviluppo dell'analisi delle proteine basata sui nanopori è solo all'inizio, afferma Behrends. "La difficoltà con il sequenziamento delle proteine è che si tratta di molecole con schemi di carica molto non uniformi". Mentre il DNA, che è caricato negativamente, migra direzionalmente nel campo elettrico e può quindi essere trascinato attraverso i pori base per base, le proteine sono costituite da blocchi costituiti da amminoacidi con cariche diverse. Di conseguenza, non è possibile il movimento diretto nel campo elettrico e la "scansione" dell'amminoacido per amminoacido. Gli scienziati di Friburgo hanno quindi fatto affidamento su un approccio diverso per i loro esperimenti. Invece di un poro con una breve costrizione, come usato nel sequenziamento del DNA, hanno usato un poro su misura con una specie di trappola molecolare. "Ciò ha permesso di catturare l'intero frammento proteico", afferma Behrends.
Non è ancora chiaro fino a quale dimensione del frammento possa essere utilizzato questo tipo di analisi. Tuttavia, ulteriori esperimenti mostrano che il metodo sarà adatto anche per l'analisi dei frammenti H4 precedentemente utilizzati nella ricerca epigenetica. Questi contengono 14 aminoacidi invece dei dieci usati qui, e sono attualmente studiati per modificazioni epigenetiche con spettrometria di massa tandem, una tecnica molto elaborata. I ricercatori sperano che i nanopori rendano l'analisi molto più semplice, veloce ed economica e che possa essere eseguita vicino al paziente.
L'ulteriore sviluppo dell'analisi dei nanopori delle proteine per la diagnostica medica e la sua implementazione in prodotti e servizi concreti è anche uno dei progetti centrali del BMBF Cluster4Future nanodiagBW, recentemente approvato, che Behrends dirige insieme al Prof. Dr. Felix von Stetten dell'Hahn- Schickard-Gesellschaft, capofila di questo progetto. + Esplora ulteriormente