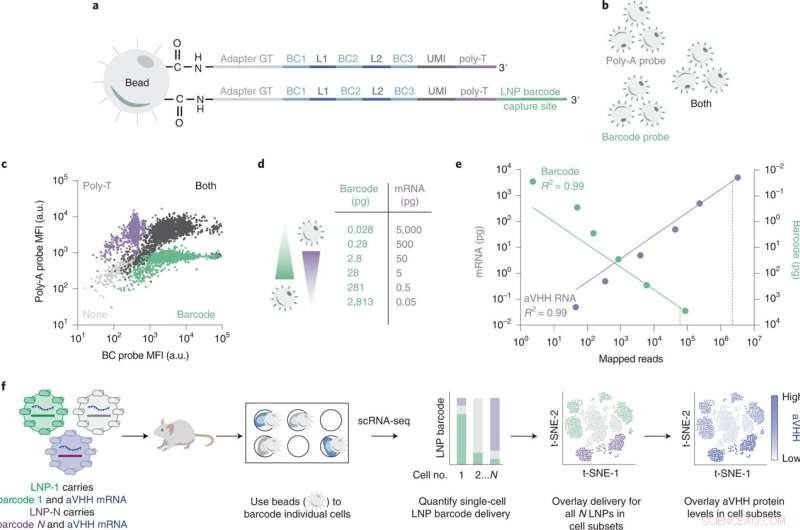
SENT-seq utilizza sequenze di acquisizione ortogonali per generare letture multiomiche sintonizzabili. Credito:Natura Nanotecnologia (2022). DOI:10.1038/s41565-022-01146-9
Le terapie basate sull'RNA messaggero, o mRNA, possono potenzialmente curare un'ampia gamma di malattie, tra cui cancro, malattie genetiche e, come il mondo ha imparato negli ultimi anni, virus mortali.
Per funzionare, questi farmaci devono essere somministrati direttamente alle cellule bersaglio in bolle di grasso su scala nanometrica chiamate nanoparticelle lipidiche o LNP:l'mRNA non è molto buono se non raggiunge il giusto tipo di cellula.
Un team di ricercatori del Georgia Institute of Technology e della Emory University's School of Medicine ha compiuto un altro passo verso il miglioramento dello sviluppo di questi veicoli per le consegne su misura, riportando il loro lavoro il 30 giugno su Nature Nanotechnology . Curtis Dobrowolski e Kalina Paunovska, tirocinanti nel laboratorio di James Dahlman, hanno sviluppato un sistema per rendere gli studi preclinici sulle nanoparticelle più predittivi. Le loro scoperte stanno già influenzando la direzione della ricerca in questo settore competitivo e in crescita.
"Sono molto entusiasta di questo studio e prevedo di spostare la maggior parte dei nostri progetti futuri su questa metodologia", ha affermato Dahlman, professore associato e professore di carriera iniziale della McCamish Foundation presso il Dipartimento di ingegneria biomedica di Wallace H. Coulter presso la Georgia Tech and Emory.
Sequenza di eventi
Negli ultimi anni, Dahlman ha collaborato con il professor Philip Santangelo di Coulter BME in un'intensa attività di ricerca. Il laboratorio di Santangelo sviluppa terapie con mRNA e il laboratorio di Dahlman lo fornisce utilizzando LNP.
Per accelerare il processo di test dell'efficacia dei loro LNP, il team di Dahlman ha sviluppato una tecnica chiamata codice a barre del DNA. In questo processo, i ricercatori inseriscono un frammento di DNA che corrisponde a un dato LNP. Gli LNP vengono quindi iniettati e le cellule vengono successivamente esaminate per la presenza dei "codici a barre" mediante sequenziamento genetico. Il sistema identifica quali codici a barre hanno raggiunto quali target specifici, evidenziando le nanoparticelle più promettenti. Poiché molte sequenze di DNA possono essere lette contemporaneamente, il processo di codifica a barre consente di eseguire molti esperimenti contemporaneamente, accelerando così la scoperta di efficaci vettori di nanoparticelle lipidiche.
Il codice a barre del DNA ha notevolmente migliorato il processo di screening preclinico delle nanoparticelle. Ma c'è ancora una barriera significativa che incide sulla somministrazione di farmaci. A causa della loro diversità, le cellule sono un po' come bersagli mobili. Dahlman ha osservato che le cellule precedentemente ritenute omogenee sono composte da sottoinsiemi cellulari distinti e vari. Il suo team ha ipotizzato che questa eterogeneità chimica e genetica abbia una potente influenza sul modo in cui gli LNP possono fornire terapie di mRNA nelle cellule.
"Le cellule non hanno solo una proteina che le definisce:sono complicate", ha detto Dahlman. "Possono essere definiti da una combinazione di cose e, se siamo onesti, sono meglio definiti utilizzando tutti i geni che esprimono o non esprimono."
Per testare la loro ipotesi, i ricercatori hanno sviluppato un nuovo strumento per misurare tutte queste cose contemporaneamente. Il loro sistema di consegna di nanoparticelle multiomiche è chiamato sequenziamento del targeting di nanoparticelle a cellula singola o SENT-seq.
Approccio multiomico
Utilizzando SENT-seq, i ricercatori sono stati in grado di quantificare il modo in cui gli LNP forniscono codici a barre del DNA e mRNA nelle cellule, la successiva produzione di proteine facilitata dal farmaco mRNA, nonché l'identità della cellula, in migliaia di singole cellule.
Questo approccio multiomico potrebbe rappresentare un importante balzo in avanti per la scoperta di LNP ad alto rendimento. La tecnica SENT-seq ha consentito al team di identificare i sottotipi cellulari che dimostrano un assorbimento di nanoparticelle particolarmente elevato o basso e i geni associati a tali sottotipi.
Quindi, oltre a testare l'efficacia di un farmaco e come alcuni sottotipi cellulari reagiscono alle nanoparticelle, stanno identificando quali geni sono coinvolti nell'assorbimento di successo degli LNP. E lo stanno facendo tutto in una volta.
"I dati suggeriscono che questi diversi sottoinsiemi cellulari hanno risposte distinte alle nanoparticelle che influenzano il modo in cui funziona una terapia con mRNA", ha detto Dahlman. "C'è ancora molto lavoro da fare, ma pensiamo che la capacità di leggere simultaneamente la consegna di nanoparticelle ad alto rendimento e la risposta cellulare alle nanoparticelle porterà a migliori terapie di mRNA".
La co-autore principale Paunovska ha affermato che lei e Dobrowolski hanno avuto l'idea per il sistema SENT-seq, "organicamente, dopo due mesi di lavoro insieme".
Dahlman added:"I'm proud of the work that Curtis, Kalina, and the team did in the lab. I think this is the beginning of an extremely interesting phase in our work." + Esplora ulteriormente