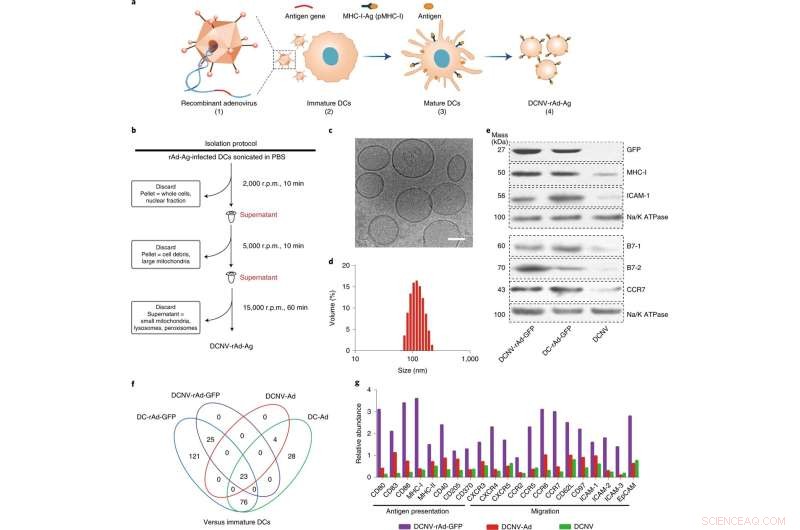
Generazione e caratterizzazione di DCNV-rAd-Ag. a, Generazione di DCNV derivati da cellule dendritiche mature infettate da adenovirus. (1) I geni dell'antigene tumore-specifico sono stati geneticamente modificati nel vettore dell'adenovirus. (2) L'adenovirus ricombinante ha infettato le cellule DC2.4 immature per esprimere l'antigene modificato sulla superficie cellulare e stimolarlo. (3) Differenziazione, maturazione e presentazione dell'antigene. (4) Raccolta della membrana cellulare matura indotta e preparazione di DCNV-rAd-Ag. b, Illustrazione schematica della generazione di DCNV-rAd-Ag. c, d, la microscopia crioelettronica (c) e le analisi dinamiche di diffusione della luce (d) hanno mostrato DCNV-rAd-Ag uniforme (diametro medio di circa 108 nm, indice di polidispersione =0,14) con una morfologia simile a una vescicola. Barra della scala, 50 nm. e, Il western blot sulle proteine di membrana da DCNV-rAd-GFP dimostra un contenuto proteico simile sulla superficie rispetto a quello delle cellule parentali. I pannelli c-e mostrano risultati rappresentativi di due esperimenti indipendenti con risultati simili. f, Confronto di proteine correlate alla risposta immunitaria sovraregolate in NV e DC. g, L'abbondanza relativa della presentazione dell'antigene e delle proteine correlate alla migrazione su DCNV-rAd-GFP. giri al minuto, giri al minuto. recettore delle chemochine CCR, CC; CXCR, recettore delle chemochine C-X-C; EpCAM, molecola di adesione cellulare epiteliale; ICAM 1, molecola di adesione intercellulare 1; pMHC-I, complesso di istocompatibilità peptide-maggiore classe I. Credit:Nature Nanotechnology (2022). DOI:10.1038/s41565-022-01098-0
Mentre le persone in tutto il mondo non vedono l'ora di aspettarsi una vita più lunga, i tumori maligni continuano a rappresentare una minaccia per la salute umana. L'esplorazione e lo sviluppo dell'immunoterapia mira a cercare nuove scoperte per il trattamento dei tumori solidi.
L'affermazione di successo dell'immunità antitumorale richiede l'attivazione, l'espansione e la differenziazione dei linfociti antigene-specifici. Questo processo dipende in gran parte dalle interazioni specifiche tra i vari linfociti T e le cellule presentanti l'antigene (APC) nel corpo. Tuttavia, i vaccini tumorali esistenti, come i vaccini neoantigeni e vari vaccini vettoriali, si basano tutti su interazioni casuali con gli APC nel corpo. Inoltre, interazioni inadeguate possono portare al silenziamento di altre risposte immunitarie.
Sebbene l'immunoterapia basata sul checkpoint immunitario abbia dimostrato di avere un grande potenziale, solo una piccola percentuale di pazienti risponde pienamente a questa terapia e i meccanismi molecolari rilevanti devono essere ulteriormente esplorati. Questo metodo di consegna è tuttavia complesso e inefficiente.
In uno sviluppo rivoluzionario, un team di scienziati guidato dal professor Chen Xiaoyuan della cattedra di Narat Muzayyin della NUS Yong Loo Lin School of Medicine e dal professor Liu Gang dell'Università di Xiamen ha formulato un nuovo vaccino che ha mostrato un'elevata efficacia nel trattamento dei tumori solidi, ottenendo risultati completa eliminazione dei tumori solidi e inducendo una memoria immunitaria di lunga durata. Ciò previene la ricaduta della crescita del tumore che il paziente aveva originariamente presentato e fornisce immunità contro tipi di tumore simili. Ciò è stato dimostrato attraverso l'applicazione di questo vaccino su modelli di tumore del melanoma. I loro risultati sono pubblicati su Nature Nanotechnology .
Il team è stato in grado di progettare una membrana di cellule dendritiche (un tipo di APC) che è stata utilizzata per stimolare naturalmente il sistema immunitario e attivare l'immunità antitumorale multidimensionale. Ciò è stato fatto attraverso una piattaforma di vaccino contro le nanovescicole di auto-presentazione dell'antigene e immunosoppressione, che ha spinto il team a coniare il suo soprannome, ASPIRE.
Il sistema vaccinale ASPIRE può suscitare rapidamente risposte immunitarie appropriate e specifiche per l'antigene in un modo che i metodi vaccinali tradizionali non potrebbero. Questa modalità di presentazione dell'antigene migliora notevolmente l'efficienza dell'attivazione immunitaria, il che facilita l'elevata efficacia di questo nuovo vaccino rispetto ad altri vaccini attualmente disponibili. Inoltre, il vaccino può anche attivare sia le cellule T precedentemente non esposte che le cellule T esaurite, il che facilita le capacità immunitarie antitumorali superiori di ASPIRE.
"Siamo entusiasti del potenziale di questa tecnologia di piattaforma per ulteriori applicazioni anche in altre malattie, come l'infezione virale cronica, in cui l'esaurimento dei linfociti T si verifica spesso durante l'infezione e impedisce il controllo virale ottimale", ha affermato il professor Chen. "In seguito, il team spera di stabilire una procedura operativa standard per la sintesi in scala del vaccino, con un adeguato controllo di qualità delle vescicole di membrana, per la traduzione clinica", ha aggiunto.
Parlando in modo indipendente sullo studio, il professor Chng Wee Joo, consulente senior della divisione di ematologia presso il dipartimento di ematologia-oncologia del National University Cancer Institute, Singapore e specialista in mieloma, ha dichiarato:"Il campo dell'immunoterapia del cancro offre enormi speranze al cancro pazienti. Tuttavia, ci sono alcune carenze con le tecnologie attuali. L'attuale innovazione del Prof Chen e dei suoi colleghi ha superato alcune di queste carenze e migliorato l'efficacia e
sostenibilità della risposta immunitaria a questi trattamenti. Ciò fornirà un significativo progresso che avrà un impatto importante sui pazienti". + Esplora ulteriormente