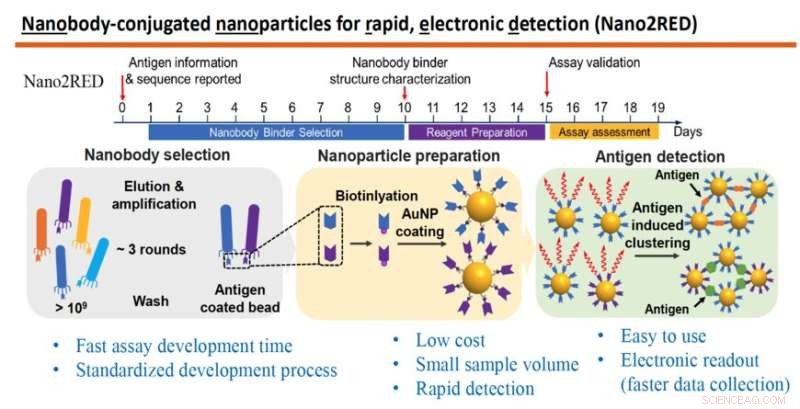
Il grafico mette in evidenza le caratteristiche chiave di Nano2RED, un metodo diagnostico innovativo inventato dal professor Wang e dai suoi colleghi. La sezione superiore illustra la rapida sequenza temporale dei passaggi per la produzione del test, che possono essere tutti eseguiti in circa 20 giorni. La sezione centrale del grafico mostra i passaggi di base coinvolti. In primo luogo, viene prodotta un'ampia libreria di anticorpi o nanocorpi sintetici e sottoposti a screening contro un antigene noto (a sinistra), quindi i nanocorpi vengono attaccati a nanoparticelle d'oro (al centro) e, infine, gli antigeni della malattia vengono rilevati in un campione quando i nanocorpi legati alle nanoparticelle d'oro si fondono con loro, producendo un risultato positivo del test, (a destra). Credito:laboratorio Wang
Negli ultimi anni, malattie infettive mortali, tra cui Ebola e COVID-19, sono emerse per causare una diffusa devastazione umana. Sebbene i ricercatori abbiano sviluppato una gamma di metodi sofisticati per rilevare tali infezioni, la diagnostica esistente deve affrontare molte limitazioni.
In un nuovo studio, Chao Wang, ricercatore presso il Biodesign Institute and School of Electrical, Computer &Energy Engineering dell'Arizona State University, insieme a colleghi e collaboratori dell'ASU presso l'Università di Washington (UW), Seattle, descrivono un nuovo metodo per rilevare virus come Virus Ebola (EBOV) e SARS CoV-2.
La tecnica, nota come Nano2RED, è una svolta intelligente sui test convenzionali ad alta precisione che si basano su protocolli di test complessi e costosi sistemi di lettura. I nanosensori in soluzione ("Nano2" nel nome) servono a rilevare gli antigeni della malattia in un campione mediante semplice miscelazione. L'innovativo processo di lettura elettronica e rapida ("RED") sviluppato nel laboratorio Wang fornisce risultati di test, che sono rilevabili come un cambiamento di colore nella soluzione campione, e registrano i dati attraverso elementi semiconduttori economici come LED e fotorilevatori.
La tecnologia rappresenta un progresso significativo nella lotta contro le malattie infettive. Può essere sviluppato e prodotto a costi molto bassi, implementato entro settimane o giorni dopo un focolaio e reso disponibile a circa 1 centesimo per test.
Rispetto ai test di laboratorio ad alta precisione ampiamente utilizzati, come ELISA, Nano2RED è molto più facile da usare. Non richiede l'incubazione o il lavaggio della superficie, l'etichettatura del colorante o l'amplificazione, ma fornisce comunque una sensibilità circa 10 volte migliore rispetto all'ELISA. Inoltre, l'uso di dispositivi a semiconduttore supporta un sistema di lettura digitale altamente portatile, che può essere sviluppato e prodotto a un costo di pochi dollari, rendendolo ideale non solo per l'uso in laboratorio, ma anche per le cliniche, l'uso domestico e remoto o località con risorse limitate. Questo approccio si basa su progetti modulari e potrebbe essere potenzialmente utilizzato per testare qualsiasi agente patogeno.
"Questa tecnologia funziona non perché è complessa, ma perché è semplice", afferma il professor Wang. "Un'altra caratteristica unica è la natura multidisciplinare del biorilevamento. Una conoscenza fondamentale di biochimica, fluidica e optoelettronica ci ha aiutato a trovare qualcosa di così 'semplice'".
Wang è ricercatore presso il Biodesign Center for Molecular Design and Biomimetics dell'ASU. È anche ricercatore presso la Scuola di Ingegneria Elettrica, Informatica ed Energetica dell'ASU; e il Centro per l'Innovazione Fotonica. Il Dr. Liangcai Gu è il collaboratore del Dipartimento di Biochimica e dell'Istituto per la progettazione proteica dell'UW, Seattle.
La ricerca appare nell'attuale numero della rivista Biosensors and Bioelectronics . Il Dr. Xiahui Chen e il Md Ashif Ikbal dell'ASU e il Dr. Shoukai Kang dell'UW sono i primi autori e Jiawei Zuo e Yuxin Pan sono gli altri autori.
Il collo di bottiglia dei test
Gli epidemiologi conoscono da tempo la formula di base per affrontare un'epidemia di malattia. Per identificare i casi e fermare il contagio, è necessario sviluppare un test o un test accurato in grado di identificare la malattia, quindi testare precocemente e spesso, per valutare il tasso di diffusione e tentare di isolare gli infetti.
Sfortunatamente, quando una nuova diagnostica è stata sviluppata, prodotta e distribuita, l'epidemia di malattia è spesso già diffusa e difficile da contenere. Inoltre, test accurati, inclusa la PCR (che può amplificare livelli minimi di acidi nucleici patogeni a livelli misurabili), sono spesso costosi, laboriosi e richiedono sofisticate strutture di laboratorio.
L'epidemia di Ebola del 2014-2016, sebbene in gran parte confinata nell'Africa occidentale, si è diffusa con una velocità terrificante, provocando panico e uccidendo più di 11.000 persone. Il tasso di letalità del virus, uno dei più alti per qualsiasi agente patogeno noto, può superare il 90%, a seconda del ceppo della malattia. La crisi è stata esacerbata da una combinazione di sistemi di sorveglianza inadeguati e infrastrutture sanitarie pubbliche scadenti.
SARS CoV-2, sebbene meno letale di Ebola, si è diffuso in tutti i paesi della terra e ha già ucciso più di 5,6 milioni di persone in tutto il mondo. In entrambi i focolai di malattia, i test diagnostici sono arrivati in ritardo sulla scena. Inoltre, i requisiti di test costosi e ingombranti hanno fatto sì che siano stati somministrati troppo pochi test, anche dopo il loro sviluppo positivo.
Il nuovo studio applica il suo metodo innovativo per testare queste due importanti malattie come prova del concetto.
Onda di marea
Una caratteristica comune a molti focolai di malattie è la velocità della luce con cui un agente patogeno, dopo aver infettato per la prima volta una manciata di persone, può prendere slancio, espandersi in tutte le direzioni e sopraffare rapidamente ospedali e operatori sanitari. Cutting off a pathogen's routes of transmission requires identifying and isolating sick individuals through testing, as quickly as possible.
During a pandemic like COVID-19, the sensitivity of a given diagnostic test is secondary to how often the test is given and how long it takes for results to be processed. A highly sensitive test is of limited use if it can only be given once, and results require a weeks-long turnaround. Research has shown that infection outbreaks are best controlled when testing is repeated in less than 3-day intervals and at a large scale.
Adequately preparing society for current and future outbreaks of infectious disease will require faster, cheaper, more accurate and more easily usable diagnostics.
Close affinity
The new technology can identify secreted glycoprotein (sGP), a telltale fingerprint of Ebola virus disease and the SARS-CoV-2 spike protein receptor binding domain (RBD). The technology is highly accurate, rivaling ELISA, a long-recognized gold standard technology for diagnostic testing.
The basic idea of such diagnostics, known as immunoassays, is simple:A sample of blood (or other biological fluid) is applied to the assay, which is adorned with antibodies. When antibodies recognize the presence of a corresponding disease antigen in the sample, they bind with it, producing a positive test result. In the ELISA test, the disease antigen needs to be immobilized on a flat surface.
Nano2RED also relies on binding affinity for positive diagnosis but instead uses floating gold nanoparticles for readout. Unlike ELISA, Nano2RED can be developed from scratch in roughly 10 days and theoretically applicable for any pathogen, providing vitally important early surveillance in the case of a disease outbreak. It can deliver test results in 15-20 minutes and may be administered at an estimated cost of a penny per test. In the current study, the new test was shown to detect Ebola's sGP in serum with a sensitivity roughly 10 times better than ELISA.
Sensing danger
In this method, the first step is to produce a very large library containing over a billion random amino acid sequences, known as nanobodies, which can act as synthetic antibodies, able to bind with target disease antigens. This vast library of nanobodies is then successively screened against the antigen in question, for example, sGP in the case of Ebola. Only those nanobodies that show strong binding affinity for the antigen are used for sensing.
Next, the selected nanobodies are affixed to gold nanoparticles that will act as probes to identify and bind with antigens present in a blood sample. In the study, a pair of two high affinity nanobodies were selected and attached to gold nanoparticles. This approach improves both the sensitivity and specificity of the test.
The key innovation of Nano2RED is the way the antigen detection is registered. As disease antigens in the sample are recognized by the nanobodies, they bind together, forming clusters of bound nanobody and antigen, like islands of algae floating on the sea surface. "Basically, an antigen works like superglue to bring the nanoparticle together," Wang says.
A 'golden' opportunity in the fight against infectious disease
The gold nanoparticles provide a stable platform to hold the nanobodies in place. Once enough binding has taken place, the bound clusters begin to sink to the bottom of the vessel. This can be detected with the naked eye in the form of a color change. The solution becomes lighter in color as the gold-nanoparticle-carried antigen-antibody clusters precipitate out, signaling detection of the pathogen.
While full precipitation of nanoparticle clusters leading to a test result can normally take several hours, the process can be sped up by centrifuging the sample, which eliminates the wait time for precipitation. In this case, just 15-20 minutes are sufficient for a result. "Of course, the gold nanoparticles are heavy, and that helps quick sedimentation, too." Wang added.
Gold nanoparticles also work to display color, not yellow but red, by absorbing light from a narrow spectral range. This absorbance feature allowed the Wang lab to invent a tiny, inexpensive device that converts this color change into an electrical signal, using color-matching semiconductor LEDs and photodetectors. Such instruments produce a rapid and accurate readout of assay results, whose limits of detection are comparable to or better than costly lab-based spectroscopy methods.
The test also delivers quantitative results based on amount of antigen detected. This could be vitally useful for estimating disease severity as well as time elapsed since the infection event. In the future, the test results can be digitized by circuits and conveniently transmitted via internet to anywhere in the world for data analysis and further scrutiny, which could be important to government policy decision-making processes and timely interruption of the transmission.
Nano2RED requires only a tiny blood sample, typically around 20 microliters. "This also makes gold inexpensive in our case, because the mount we need is so tiny," Wang said. Unlike conventional methods, Nano2RED is also very simple to use with minimal training involved for healthcare personnel. It does not require any time-consuming and expensive incubation, washing, fluorescent labeling or amplification.
Future research will help improve the assay's limits of detection even further and modify its detection capacities to include virion particles, extracellular vesicles, small molecules, and nucleic acids.
"There is certainly still a lot to explore," Wang added, "but we so far have a happy marriage between engineering disciplines and biology. And that is what we will continue to work on." + Esplora ulteriormente