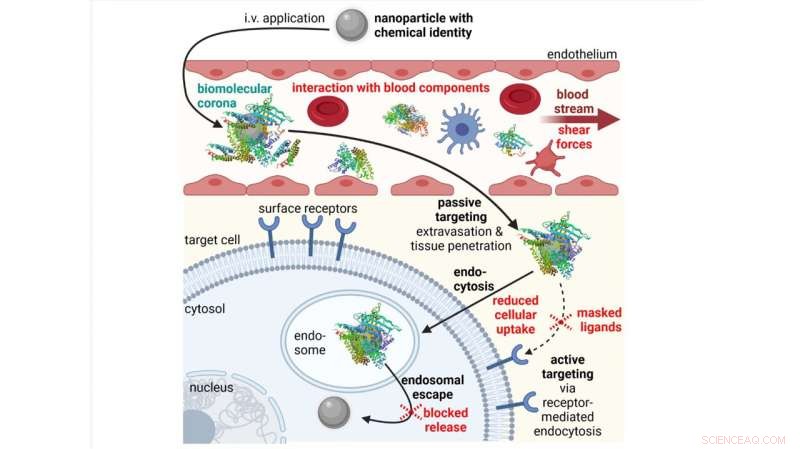
Ostacoli (in rosso) nel processo di consegna in vivo di nanoparticelle applicate per via endovenosa (IV). Crediti:Simone Berger, Martin Berger, Christoph Bantz, Michael Maskos e Ernst Wagner
I vaccini a RNA messaggero (mRNA) sono un ottimo esempio del promettente campo della nanomedicina. Ma i progressi nella progettazione e applicazione delle nanoparticelle come veicoli di consegna efficienti per biofarmaci contenenti acido nucleico o sostanze farmacologiche proteiche sono, sfortunatamente, notevolmente lenti.
Un recente ostacolo alla ricerca sulla somministrazione di farmaci è una debole correlazione osservata tra in vitro (al di fuori di un organismo vivente) e in vivo (all'interno di un organismo vivente) performance. Questo problema non era chiaro nelle fasi iniziali, quando la somministrazione cellulare di un nanocarrier di farmaci veniva testata principalmente all'interno di colture cellulari standard. Con l'emergere di studi farmacologici in vivo avanzati su topi o pazienti umani, la scarsa affidabilità e validità dei test su colture cellulari per applicazioni terapeutiche sta diventando evidente.
Quando le nanoparticelle vengono applicate per via endovenosa, devono affrontare diversi ostacoli che differiscono dalle situazioni in vitro, come quando incontrano componenti del sangue. Le nanoparticelle sono solitamente ricoperte da un multistrato biomolecolare (una corona proteica), che altera le proprietà fisico-chimiche, la farmacocinetica e il profilo di tossicità delle nanoparticelle.
In Recensioni di biofisica , i ricercatori in Germania forniscono una caratterizzazione all'avanguardia della corona proteica formata attorno alle nanoparticelle e del suo impatto sulle proprietà fisico-chimiche e biologiche di queste nanoparticelle.
"Quando si predicono le prestazioni in vivo dai dati in vitro, si raccomanda di combinare diversi metodi di caratterizzazione analitica e biologica per ottenere informazioni più dettagliate sulle caratteristiche in vivo e sul comportamento delle nanoparticelle", ha affermato Simone Berger, coautore di Ludwig Maximilian Università di Monaco.
La scelta del biofluido (siero, plasma o sangue intero e di origine animale) e la definizione di protocolli standardizzati sono di grande importanza per una preclinica più coerente, robusta e completa studi per derivare relazioni struttura-attività e in vitro/in vivo correlazioni.
"Le conoscenze acquisite sulla formazione della corona proteica possono essere sfruttate per ottimizzare i vettori per l'applicazione nanomedica", ha affermato Berger.
Informazioni come la biodistribuzione in vivo e gli effetti fuori bersaglio non possono essere ottenuti da esperimenti in vitro, sottolineano i ricercatori. Ma i nuovi metodi di screening ad alto rendimento come il sistema di codici a barre possono fare in vivo indagini più efficaci, economiche ed etiche.
Permangono alcune incertezze sulla traducibilità da piccoli a grandi animali e esseri umani, ma la bioinformatica potrebbe aiutare a identificare i modelli animali più adatti per determinate malattie.
"Alternative ai modelli animali, come la tecnologia microfluidica 'organo umano su chip' o le previsioni computazionali, potrebbero essere strategie promettenti per sostituire gli studi sugli animali in futuro", ha affermato Berger.
La nanomedicina mostra "un grande potenziale per rivoluzionare il panorama terapeutico con un'ampia gamma di applicazioni come vaccini/immunoterapia contro il cancro o trattamento di malattie genetiche", ha affermato Berger. "Con saggi in vitro adeguati e più predittivi, la pipeline preclinica diventerà più efficiente, più veloce ed economica. E, soprattutto, gli esperimenti sugli animali possono essere sostituiti o almeno ridotti". + Esplora ulteriormente