Il rilascio intracellulare di proteine è una tecnica importante per svelare le funzioni cellulari, la struttura del complesso proteico e le proprietà terapeutiche. Tuttavia, i metodi di consegna convenzionali presentano diverse limitazioni.
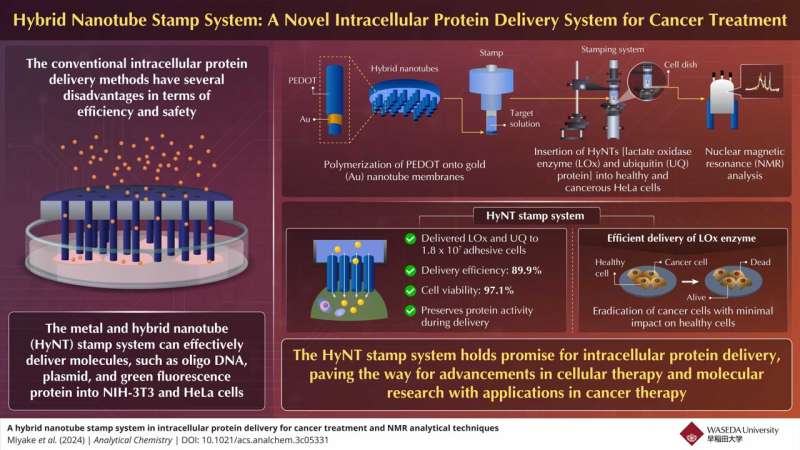
Per risolvere questo problema, i ricercatori giapponesi hanno sviluppato un nuovo sistema di timbri di nanotubi ibridi (HyNT) in grado di fornire più proteine con tassi di efficienza e vitalità elevati. Questo sistema rappresenta un progresso nella somministrazione di proteine intracellulari, offrendo un'iniezione precisa di agenti terapeutici nelle cellule bersaglio.
Nel panorama medico odierno, la medicina di precisione e le terapie mirate stanno guadagnando terreno grazie alla loro capacità di personalizzare i trattamenti per i singoli pazienti riducendo al minimo gli effetti avversi.
I metodi convenzionali, come le tecniche di trasferimento genico, si dimostrano promettenti nel fornire geni terapeutici direttamente alle cellule per affrontare varie malattie. Tuttavia, questi metodi devono affrontare notevoli inconvenienti, che ne compromettono l'efficacia e la sicurezza.
La somministrazione di proteine intracellulari offre un approccio promettente per lo sviluppo di terapie più sicure, più mirate ed efficaci. Trasferendo direttamente le proteine nelle cellule bersaglio, questo metodo aggira problemi come il silenziamento durante la trascrizione e la traduzione e il rischio di mutazioni indesiderate derivanti dall'inserimento del DNA. Inoltre, il rilascio di proteine intracellulari consente una distribuzione precisa delle proteine terapeutiche all'interno delle cellule bersaglio senza causare tossicità.
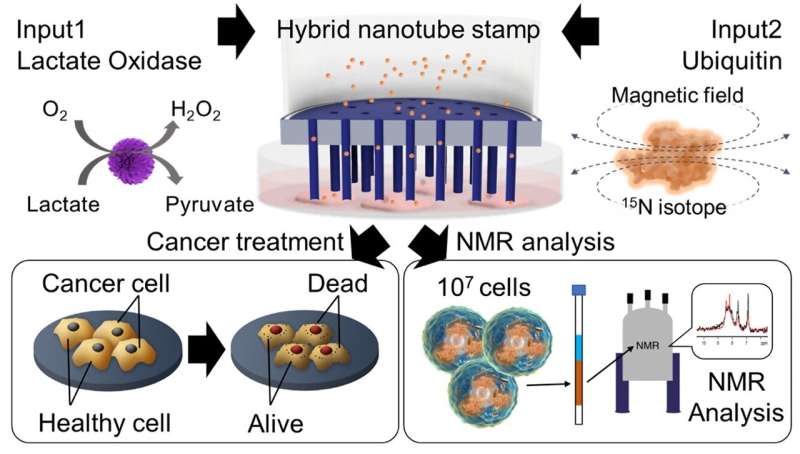
Un gruppo di ricercatori guidati dal professor Takeo Miyake dell’Università di Waseda, in Giappone, in collaborazione con il gruppo Mikawa del RIKEN Institute, hanno ora sviluppato un sistema ibrido di nanotubi per il rilascio intracellulare di proteine. Questa tecnica innovativa consente il rilascio simultaneo di diversi carichi, tra cui il colorante calceina, l'enzima lattato ossidasi (LOx) e la proteina ubiquitina (UQ), direttamente nelle cellule adesive per il trattamento del cancro.
Un articolo che descrive la ricerca è pubblicato su Analytical Chemistry . Questo articolo è stato scritto in collaborazione dal Dr. Tsutomu Mikawa, dal Dr. Masaomi Ikari, dal Dr. Hiromasa Yagi, dal Dr. Naoya Tochio e dal Dr. Takanori Kigawa del RIKEN Center for Biosystems Dynamics Research, Giappone e dal Sig. Bowen Zhang, dal Sig. Bingfu Liu, il signor Zhouji Wu e il signor Kazuhiro Oyama dell'Università di Waseda, Giappone.
Miyake spiega brevemente l'assemblaggio del sistema di timbri. "Gli HyNT sono stati sintetizzati tramite polimerizzazione PEDOT su membrane di nanotubi di Au e quindi assemblati con un tubo di vetro per creare un timbro in grado di inserire fisicamente gli HyNT nelle cellule."
I ricercatori hanno esplorato il potenziale terapeutico della fornitura dell'enzima LOx per il trattamento del cancro. "Attraverso il nostro innovativo sistema di timbratura, abbiamo somministrato con successo LOx sia nelle cellule staminali mesenchimali sane (MSC) che nelle cellule HeLa cancerose. Mentre le cellule MSC sono rimaste inalterate, abbiamo osservato una morte cellulare significativa nelle cellule tumorali HeLa dopo il trattamento LOx con vitalità in diminuzione nel tempo.
"I nostri risultati evidenziano la promettente efficacia del LOx somministrato per via intracellulare nel colpire e uccidere selettivamente le cellule tumorali, risparmiando al contempo le cellule sane, offrendo una strategia terapeutica mirata per il trattamento del cancro", spiega Miyake.
Alla fine, il team ha consegnato con successo 15 Proteine UQ marcate con isotopi N nelle cellule HeLa utilizzando il sistema di timbro HyNT. Questa consegna ha consentito l'analisi di strutture proteiche complesse e di interazioni all'interno delle cellule.
Inoltre, l'imaging ottico e a fluorescenza ha confermato la presenza di UQ rilasciato nelle cellule HeLa e la spettroscopia di risonanza magnetica nucleare ha confrontato la concentrazione intracellulare della proteina UQ con quella di una soluzione contenente 15 UQ etichettato N.
Questi risultati dimostrano l'efficacia del sistema stamp nel fornire proteine bersaglio per le successive analisi.
I risultati dimostrano la notevole capacità del sistema HyNT stamp di fornire LOx e UQ in un numero considerevole di celle adesive, come richiesto per le applicazioni di medicina rigenerativa.
Il sistema ha raggiunto un'efficienza di distribuzione particolarmente elevata pari all'89,9%, indicando la sua efficacia nel trasportare con precisione le proteine terapeutiche nelle cellule bersaglio. Inoltre, il tasso di vitalità cellulare del 97,1% evidenzia la capacità del sistema di mantenere la salute e l'integrità delle cellule trattate durante tutto il processo di consegna.
Il sistema HyNT stamp offre un potenziale di trasformazione nel rilascio di proteine intracellulari, con applicazioni che spaziano dal trattamento del cancro all’analisi molecolare. Oltre alla medicina, la sua versatilità si estende all'agricoltura e alle industrie alimentari, promettendo progressi nella produzione agricola e nello sviluppo di prodotti alimentari.
Con una manipolazione precisa delle cellule e una consegna efficiente, il sistema di timbri HyNT è pronto a rivoluzionare la ricerca biomedica, la pratica clinica e diversi settori, aprendo la strada a interventi personalizzati e plasmando il futuro della medicina moderna.
Ulteriori informazioni: Bowen Zhang et al, Un sistema ibrido di nanotubi per la somministrazione di proteine intracellulari per il trattamento del cancro e tecniche analitiche NMR, Chimica analitica (2024). DOI:10.1021/acs.analchem.3c05331
Informazioni sul giornale: Chimica Analitica
Fornito dall'Università Waseda