I farmaci a base proteica devono essere trasportati all’interno delle cellule in modo da impedirne la degradazione immediata. Un nuovo approccio mira a garantire che rimangano intatti solo in alcune cellule, come le cellule tumorali. In uno studio pubblicato sulla rivista Angewandte Chemie International Edition , un gruppo di ricerca giapponese ha introdotto un nanocarrier che può "sfuggire" agli endosomi prima che il suo carico venga distrutto lì. Questa capacità di fuga viene attivata solo all'interno degli endosomi di alcune cellule tumorali.
L'assorbimento dei nanoportatori nelle cellule avviene per endocitosi:quando un nanoportatore atterra sulla superficie cellulare, la membrana cellulare si ripiega e lo racchiude in una bolla, chiamata endosoma, che poi scivola all'interno della cellula. Nella sua fase tardiva, l'endosoma si fonde con i lisosomi che contengono enzimi, formando un endolisosoma. All'interno di questa struttura, gli enzimi scompongono sia il materiale proveniente dal corpo che il materiale estraneo.
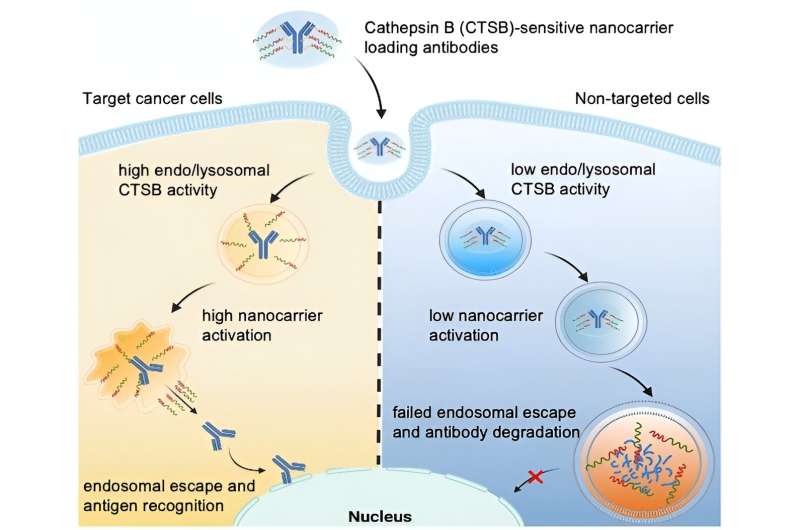
Un farmaco a base proteica può diventare attivo solo se "sfugge" all'endolisosoma prima di essere scomposto. Questo è noto come "fuga endosomiale". Alcuni nanovettori possono aprire la membrana endo/lisosomiale e quindi avere capacità di fuga endosomiale.
Guidato da Kazunori Kataoka e Horacio Cabral, il team mira a fare un ulteriore passo avanti producendo nanovettori per i quali la fuga endosomiale viene attivata solo quando entrano in cellule molto specifiche, come le cellule tumorali. Ciò proteggerebbe le cellule sane. I ricercatori sfruttano il fatto che diversi tipi di cellule hanno attività enzimatiche endolisosomiali molto diverse. Ad esempio, l'attività della proteasi catepsina B (CTSB) è particolarmente elevata nelle cellule tumorali.
Utilizzando speciali molecole sonda a fluorescenza, il team dell'Università di Tokyo e del Kawasaki Institute of Industrial Promotion ha inizialmente studiato l'attività del CTSB e la degradazione delle proteine negli endosomi. Hanno determinato che nelle cellule tumorali con endosomi altamente acidi, l’attività del CTSB è già molto elevata nella loro fase iniziale, significativamente prima che la degradazione delle proteine aumenti. I ricercatori sfruttano questa finestra temporale utilizzando nanovettori la cui capacità di fuga endosomiale è attivata dal CTSB nelle cellule tumorali.
Il team ha costruito nanovettori a base di poli(etilenglicole) con gruppi diamminoetano in grado di "strappare" le membrane endo/lisosomiali. Usando un linker, hanno poi attaccato gli anticorpi per fungere da modello per un farmaco proteico. Il nanocarrier protegge gli "strumenti di strappo" in modo che siano inizialmente inattivi.
Il linker è progettato per essere diviso dal CTSB negli endolisosomi. Questo separa il carico dal vettore, attivando gli strumenti di strappo. Aprono la membrana endo/lisosomiale e rilasciano anticorpi intatti all'interno della cellula, ma solo nelle cellule tumorali che hanno un'attività CTSB endosomiale elevata.
Questo metodo potrebbe rappresentare una nuova strategia per il rilascio specifico delle cellule di farmaci attraverso nanovettori sensibili allo stimolo con fuga endosomiale controllata.
Ulteriori informazioni: Pengwen Chen et al, Consegna intracellulare selettiva di anticorpi nelle cellule tumorali con nanocarrier che rilevano l'attività enzimatica endo/lisosomiale, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317817
Informazioni sul giornale: Edizione Internazionale Angewandte Chemie
Fornito da Wiley