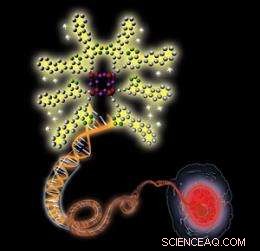
Illustrazione schematica che mostra una nanosonda carica positivamente (in alto a sinistra) che si lega a una molecola di DNA a doppio filamento caricata negativamente (al centro), con conseguente maggiore fluorescenza che consente la visualizzazione di un nucleo cellulare (in basso a destra). Credito:2010 Wiley-VCH
I nuclei sono complessi, organelli ben definiti che trasportano informazioni genetiche fondamentali per la cellula. Visualizzare questi organelli attraverso tecniche di imaging a fluorescenza promette di rivelare i meccanismi che governano le informazioni genetiche e fornire modi per prevedere e curare le malattie genetiche. Lavorando a stretto contatto con Xinhai Zhang presso l'A*STAR Institute of Materials Research and Engineering, un gruppo di ricerca guidato da Bin Liu presso l'Università Nazionale di Singapore ha ora sviluppato un metodo per creare ultrapiccoli, nanosonde fluorescenti altamente selettive per una tecnica di imaging del nucleo cellulare nota come microscopia a fluorescenza eccitata a due fotoni (TPEF).
I ricercatori hanno proposto una serie di sostanze fluorescenti per illuminare i nuclei all'interno delle cellule. Però, fenomeni indotti dalla luce, come l'autofluorescenza cellulare e il fotodanneggiamento grave, tendono a degradare le prestazioni di queste sonde.
Nella tecnica TPEF, ogni nanosonda produce un segnale fluorescente assorbendo non uno ma due fotoni a bassa energia di luce nel vicino infrarosso. Questo processo a due fotoni riduce significativamente gli effetti del fotodanneggiamento e dell'autofluorescenza cellulare, migliorando nel contempo la risoluzione, rendendo il TPEF vantaggioso rispetto alla tradizionale microscopia a fluorescenza a un fotone.
"L'imaging TPEF è più potente dell'imaging a un fotone, in particolare per l'imaging in vivo e tissutale in cui esiste una forte autofluorescenza biologica, "dice Zhang.
Invece di una tradizionale sintesi passo passo, i ricercatori hanno adottato un approccio "dal basso verso l'alto" per sintetizzare le nanosonde per il loro schema TPEF. Queste nanosonde sono costituite da minuscole gabbie di silicio-ossigeno inorganiche circondate da brevi catene polimeriche cariche positivamente. Il team ha ottenuto separatamente gabbie e catene prima di unirle insieme, e la sintesi si presta bene alla produzione di nanosonde TPEF con vari colori di emissione di luce e capacità di bioriconoscimento.
Il piccolo, gabbie rigide facilitano l'incorporazione delle sonde nei nuclei cellulari, mentre le catene caricate positivamente e sensibili alla luce contribuiscono alla solubilità in acqua e alle proprietà ottiche. Secondo Liu, queste caratteristiche si combinano per produrre infine sonde di illuminazione adatte al TPEF.
Il team ha scoperto che la fluorescenza delle sonde diventava sostanzialmente più intensa dopo l'esposizione agli acidi nucleici, come DNA e RNA a doppio filamento. Questo perché le sonde con carica positiva si legano strettamente agli acidi nucleici con carica negativa attraverso interazioni elettrostatiche attraenti, aumentando l'idrofobicità microambientale delle sonde e la loro fluorescenza. Per di più, le sonde hanno colorato selettivamente i nuclei del cancro al seno e le cellule sane a bassa tossicità.
I ricercatori stanno attualmente espandendo la loro collezione di sonde per includere altre applicazioni target intracellulari. Stanno inoltre ottimizzando ulteriormente le prestazioni TPEF delle sonde. “Queste nanosonde possono aprire nuovi modi di interrogare i sistemi biologici in modo sicuro e ad alto contrasto, "dice Zhang.