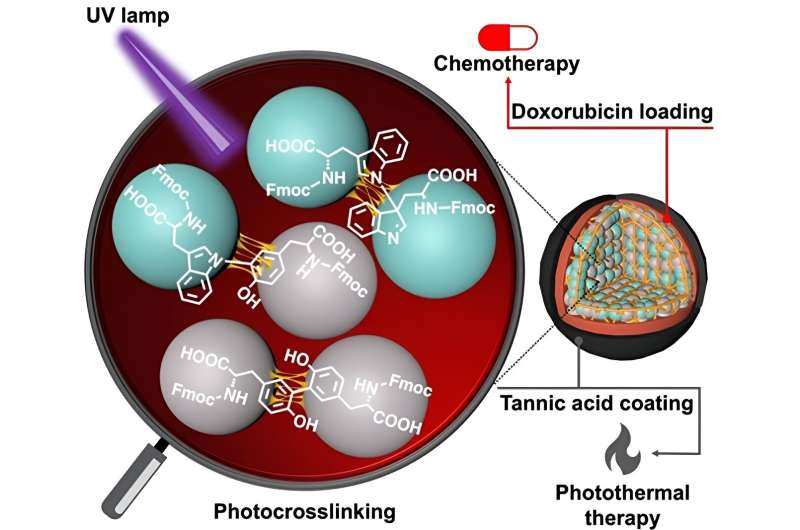
Gli amminoacidi, come la tirosina e il triptofano, sono gli elementi costitutivi fondamentali che compongono le proteine. Queste biomolecole hanno gruppi chimici diversi su ciascuna estremità e catena laterale e quindi hanno la capacità naturale di formare una catena attraverso la formazione di un legame ammidico (peptidico). Tuttavia, tali legami sono deboli e facilmente degradabili in condizioni fisiologiche. È qui che entrano in gioco gli aminoacidi protetti da Fmoc.
In un nuovo studio ora, un gruppo di ricerca guidato dal Dr. Eijiro Miyako, Professore Associato, Japan Advanced Institute of Science and Technology (JAIST) e dal Dr. Alberto Bianco e dalla Dr. Cécilia Ménard-Moyon del Centre National de la Recherche Scientifique ( CNRS), Francia, ha utilizzato la luce ultravioletta a 254 nm (che porta alle nanoparticelle CBPUV) e la reticolazione mediata da riboflavina a 365 nm (che porta alle nanoparticelle CBPRibo) per reticolare gli amminoacidi protetti da Fmoc.
"Gli amminoacidi, essendo gli elementi costitutivi delle proteine, presentano numerosi vantaggi, come una migliore biocompatibilità. Pertanto, volevamo creare nuove nanoparticelle autoassemblate a base di amminoacidi che possano essere attivate attraverso molteplici meccanismi", afferma il dott. Eijiro Miyako. I risultati di questo studio sono pubblicati su Small .
Gli amminoacidi autoassemblati erano dimeri reticolati stabilmente di Fmoc-Tyr-OH (tirosina) e Fmoc-Trp-OH (triptofano). La doxorubicina, un farmaco antitumorale, è stata successivamente caricata nelle nanoparticelle di amminoacidi reticolate.
Per aumentare la stabilità delle nanoparticelle, i ricercatori hanno utilizzato un acido tannico-ferro (Fe 3+ ) complesso (o TAF) come strato esterno di rivestimento. Questo rivestimento può degradarsi all'interno delle cellule attraverso il rilascio enzimatico del glutatione o attraverso la differenza di pH nel microambiente tumorale. Il rivestimento di acido tannico può essere utilizzato anche nella terapia antitumorale fototermica, in cui la luce esterna può aumentare la temperatura locale che circonda il tessuto tumorale, causando la morte delle cellule tumorali.
Le nanoparticelle sintetizzate sono state poi ampiamente studiate per la loro integrità strutturale, stabilità e rilascio del farmaco in diverse condizioni di pH. Il profilo funzionale, l'assorbimento cellulare e la biocompatibilità delle nanoparticelle di amminoacidi autoassemblate sono stati poi studiati utilizzando tecniche di coltura cellulare.
Infine, l’efficacia antitumorale delle nanoparticelle sintetizzate è stata analizzata nei topi portatori di tumore. L'approccio combinato di chemioterapia, grazie all'azione della doxorubicina, e terapia fototermica grazie al rivestimento di acido tannico, ha mostrato un'eccellente attività antitumorale.
Dopo la reticolazione, le nanoparticelle a base di amminoacidi hanno mostrato notevoli cambiamenti di colore, dimensione, assorbanza, fluorescenza e stabilità termica. Inoltre, CBPUV ha mostrato stabilità superiore dopo la reticolazione, rispetto a CBPRibo. Anche CBPUV ha mantenuto costantemente la sua struttura, mentre CBPRibo ha mostrato un parziale disassemblaggio, formando sfere cave.
Lo studio sul rilascio del farmaco ha rivelato un rilascio minimo del farmaco a pH fisiologico (7,4), indicando che il rivestimento stabile è fondamentale per la somministrazione in vivo. A pH 5,5, la degradazione incompleta del rivestimento ha comportato un rilascio trascurabile del farmaco. Tuttavia, l'aggiunta di glutatione (GSH) a pH 5,5 ha aumentato significativamente il rilascio del farmaco innescando la degradazione del rivestimento TAF, indicando la reattività GSH/pH.
Il trattamento combinato acido e GSH ha intensificato la degradazione del rivestimento. Questo comportamento reattivo consente il rilascio controllato del farmaco in condizioni fisiologiche specifiche. Inoltre, le valutazioni in vitro hanno rivelato una citotossicità concentrazione-dipendente e una migliore efficacia nella terapia combinata chemio/fototermica. Studi in vivo su topi portatori di tumore hanno mostrato una significativa inibizione della crescita del tumore, indicando promettenti effetti antitumorali senza effetti collaterali osservati.
Il Dott. Miyako ha affermato:"La nanotecnologia promette di trasformare la scienza di laboratorio di base in un potente strumento per combattere malattie complesse come il cancro. Siamo ottimisti sul fatto che questa ricerca pionieristica progredirà, evolvendosi potenzialmente in una tecnologia all'avanguardia per il trattamento del cancro, pronta per le sperimentazioni cliniche entro dieci anni." anni."
Andando avanti, lo sviluppo di queste nanoparticelle di amminoacidi autoassemblate può aiutare a combattere problemi critici come la resistenza multifarmaco nel cancro e migliorare l'efficacia complessiva dei risultati del trattamento.
Ulteriori informazioni: Tengfei Wang et al, Nanoparticelle di amminoacidi co-assemblate fotoreticolate per la terapia antitumorale combinata chemio/fototermica controllata, Piccolo (2023). DOI:10.1002/piccolo.202307337
Informazioni sul giornale: Piccolo
Fornito dal Japan Advanced Institute of Science and Technology