La barriera ematoencefalica blocca l’ingresso degli anticorpi nel cervello. Ciò limita il potenziale utilizzo di terapie anticorpali per il trattamento di malattie cerebrali, come i tumori al cervello.
In altre parti del corpo, più di 100 anticorpi terapeutici approvati dalla Food and Drug Administration degli Stati Uniti vengono utilizzati dalle équipe mediche per trattare tumori e malattie autoimmuni, infettive e metaboliche. Trovare modi per trasportare anticorpi terapeutici attraverso la barriera ematoencefalica, dal flusso sanguigno periferico al sistema nervoso centrale, potrebbe creare trattamenti efficaci che agiscono nel cervello.
In un nuovo studio pubblicato sulla rivista Frontiers in Cell and Developmental Biology , i ricercatori dell'Università dell'Alabama a Birmingham riferiscono che l'aggiunta localizzata di un polimero biodegradabile approvato dalla FDA nelle regioni cerniera e vicino alla cerniera dell'anticorpo terapeutico trastuzumab ha facilitato efficacemente la distribuzione nel cervello di questo anticorpo monoclonale IgG1 umano. Trastuzumab è usato per trattare il cancro al seno e molti altri tumori.
Il lavoro preliminare su questa nuova piattaforma comprendeva esperimenti in vitro e su modelli murini. I ricercatori affermano che il sistema di somministrazione deve ancora essere ottimizzato e testato ulteriormente, ma notano che la loro semplice metodologia converte la terapia anticorpale in una forma somministrabile al cervello che mantiene la funzionalità medica dell'anticorpo.
"Le preoccupazioni relative all'ingresso nel cervello infestano lo sviluppo di terapie anticorpali mirate alle malattie cerebrali, impedendo la traduzione medica degli anticorpi generati in laboratorio nelle pratiche cliniche", ha affermato Masakazu Kamata, Ph.D., leader dello studio e professore associato presso il Dipartimento di Microbiologia dell'UAB. "In questo contesto, questa semplice metodologia ha un grande potenziale per fungere da piattaforma non solo per riutilizzare le attuali terapie anticorpali, ma anche per incoraggiare la progettazione di nuovi anticorpi per il trattamento delle malattie del cervello."
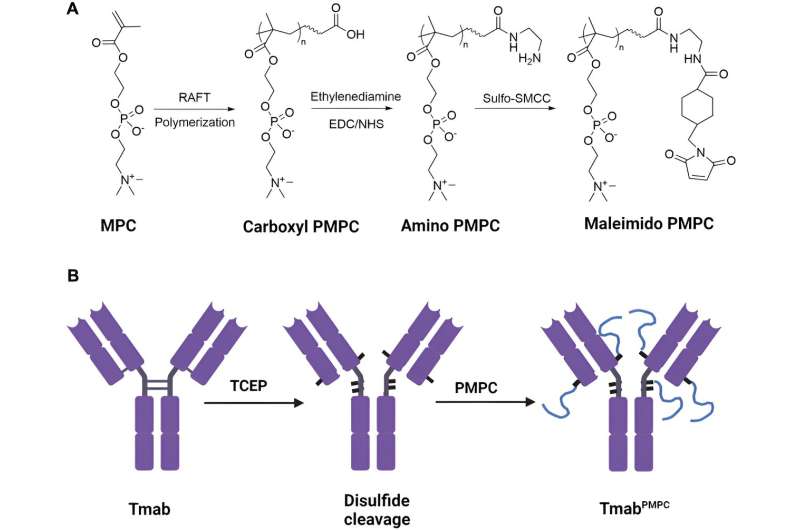
Il polimero biocompatibile utilizzato era poli 2-metacriloilossietilfosforilcolina, o PMPC, con lunghezze di catena di 50, 100 o 200 monomeri. I ricercatori avevano già scoperto che questo polimero non immunogenico, che la FDA ha approvato come materiale di rivestimento per dispositivi trapiantabili, potrebbe legarsi a due recettori sulle cellule endoteliali microvascolari del cervello che compongono la barriera ematoencefalica, e tali cellule potrebbero quindi spostare il polimero attraverso la barriera ematoencefalica mediante transcitosi. La transcitosi è un trasporto specializzato mediante il quale il carico extracellulare viene portato all'interno della cellula, trasportato attraverso il citoplasma fino all'altro lato della cellula e quindi rilasciato.
I ricercatori dell'UAB sono stati in grado di scindere quattro legami disolfuro intercatena nella cerniera di trastuzumab IgG1 e nelle regioni vicine alla cerniera, creando gruppi tiolici. Ciascun gruppo tiolico è stato quindi coniugato a una catena del PMPC per creare molecole di trastuzumab con una delle tre lunghezze di catena, che hanno indicato come Tmab-PMPC50, Tmab-PMPC100 e Tmab-PMPC200.
Ciascuno di questi anticorpi modificati manteneva comunque il legame specifico di trastuzumab con le cellule che esprimevano l’antigene HER2, il bersaglio di trastuzumab. Sia Tmab-PMPC50 che Tmab-PMPC100 sono stati internalizzati in cellule HER2-positive e hanno promosso la morte cellulare anticorpo-dipendente, che è la funzionalità medica mediante la quale trastuzumab uccide le cellule di cancro al seno HER2+.
I ricercatori hanno poi dimostrato che la coniugazione PMPC di trastuzumab migliora la penetrazione della barriera ematoencefalica attraverso le cellule epiteliali della barriera ematoencefalica attraverso la via della transcitosi. Il Tmab-PMPC100 traslocabile si è rivelato il migliore in termini di efficace penetrazione della barriera ematoencefalica pur mantenendo il riconoscimento dell'epitopo di trastuzumab, la capacità dell'anticorpo di legarsi al suo bersaglio antigene.
In un modello murino, sia Tmab-PMPC100 che Tmab-PMPC200 erano circa cinque volte migliori nella penetrazione cerebrale rispetto al trastuzumab nativo. In esperimenti preliminari in vitro e su modelli murini, il trastuzumab modificato con polimero non ha indotto neurotossicità, non ha mostrato effetti avversi sul fegato e non ha compromesso l'integrità della barriera emato-encefalica.
"Questi risultati indicano collettivamente che la coniugazione di PMPC raggiunge un'efficace somministrazione al cervello di anticorpi terapeutici, come trastuzumab, senza induzione di effetti avversi, almeno nel fegato, nella barriera ematoencefalica o nel cervello", ha affermato Kamata.
Altri hanno anche studiato modi per far passare anticorpi simili attraverso la barriera emato-encefalica, hanno osservato i ricercatori.
Nel lavoro che ha portato allo studio attuale, i ricercatori dell’UAB hanno dimostrato di poter avvolgere vari carichi macromolecolari all’interno dei gusci PMPC, e queste nanocapsule hanno dimostrato una circolazione sanguigna prolungata, una ridotta immunogenicità e una migliore consegna del cervello nei topi e nei primati non umani.
Tuttavia questo sistema presentava degli inconvenienti. Le nanocapsule richiedevano l'aggiunta di ligandi mirati per portarle al bersaglio della malattia e di reticolanti degradabili che avrebbero consentito il rilascio del carico in quel sito. Sfortunatamente, i microambienti associati alle malattie spesso non presentano condizioni che possano innescare il degrado dei reticolanti.
Altri ricercatori che cercano di violare la barriera emato-encefalica hanno studiato vari ligandi diversi dal PMPC per potenziare il trasporto, come ligandi derivati da microbi e tossine o proteine endogene come le lipoproteine. Questi generalmente hanno avuto proprietà superficiali indesiderabili, come essere altamente immunogenici, altamente idrofobici o carichi. PMPC non presenta questi tratti indesiderati.
Coautori con Kamata nello studio, "Coniugazione sito-orientata di poli(2-metacrilossietil fosforilcolina) per una migliore somministrazione cerebrale di anticorpi", sono Jie Ren, Chloe E. Jepson, Charles J. Kuhlmann, Stella Uloma Azolibe e Madison T Blucas, Dipartimento di Microbiologia dell'UAB; Sarah L. Nealy e Eugenia Kharlampieva, Dipartimento di Chimica dell'UAB; Satoru Osuka, Dipartimento di Neurochirurgia dell'UAB; e Yoshiko Nagaoka-Kamata, Dipartimento di Patologia dell'UAB.
Ulteriori informazioni: Jie Ren et al, Coniugazione orientata al sito di poli(2-metacrilossietilfosforilcolina) per una migliore somministrazione di anticorpi al cervello, Frontiers in Cell and Developmental Biology (2023). DOI:10.3389/fcell.2023.1214118
Fornito dall'Università dell'Alabama a Birmingham