Alcuni vaccini COVID-19 hanno utilizzato in modo sicuro ed efficace nanoparticelle lipidiche (LNP) per fornire RNA messaggero alle cellule. Un nuovo studio del MIT mostra che diverse nanoparticelle potrebbero essere utilizzate per una potenziale terapia contro la malattia di Alzheimer (AD). Nei test condotti su più modelli murini e con cellule umane in coltura, una formulazione LNP recentemente personalizzata ha consegnato in modo efficace piccoli RNA interferenti (siRNA) alle cellule immunitarie della microglia del cervello per sopprimere l'espressione di una proteina legata all'eccessiva infiammazione nel morbo di Alzheimer.
In uno studio precedente, i ricercatori hanno dimostrato che il blocco delle conseguenze dell'attività della proteina PU.1 aiuta a ridurre la neuroinfiammazione e la patologia legate al morbo di Alzheimer. I nuovi risultati, riportati nella rivista Advanced Materials , ottengono una riduzione dell'infiammazione reprimendo direttamente l'espressione del gene Spi1 che codifica PU.1.
Più in generale, il nuovo studio dimostra anche un nuovo modo di fornire RNA alle microglia, che finora è stato difficile individuare.
La co-autrice senior dello studio Li-Huei Tsai, professoressa di neuroscienze a Picower e direttrice del Picower Institute for Learning and Memory and Aging Brain Initiative, ha affermato di aver ipotizzato che gli LNP potrebbero funzionare come un modo per portare siRNA nella microglia perché le cellule, che cancellano rifiuti nel cervello, hanno una forte propensione ad assorbire le molecole lipidiche.
Ne ha discusso con Robert Langer, professore del David Koch Institute, ampiamente noto per il suo lavoro fondamentale sulla somministrazione di farmaci tramite nanoparticelle; hanno deciso di testare l'idea di ridurre l'espressione di PU.1 con un siRNA fornito da LNP.
"Ricordo ancora il giorno in cui ho chiesto di incontrare Bob per discutere l'idea di testare gli LNP come carico utile per colpire la microglia infiammatoria", ha detto Tsai, membro della facoltà del Dipartimento di Scienze cerebrali e cognitive. "Sono molto grato alla Fondazione JPB, che ha sostenuto questa idea senza alcuna prova preliminare."
Lo studente laureato del Langer Lab Jason Andresen e l'ex postdoc del Tsai Lab William Ralvenius hanno guidato il lavoro e sono i co-autori principali dello studio. Owen Fenton, ex postdoc del Langer Lab e ora assistente professore presso la Eshelman School of Pharmacy dell'Università della Carolina del Nord, è un autore co-corrispondente insieme a Tsai e Langer. Langer è professore di ingegneria chimica, ingegneria biologica e del Koch Institute for Integrative Cancer Research.
Il modo più semplice per verificare se il siRNA potesse sopprimere terapeuticamente l'espressione di PU.1 sarebbe stato quello di utilizzare un dispositivo di somministrazione già disponibile, ma una delle prime scoperte dello studio è che nessuno degli otto reagenti disponibili in commercio potrebbe trasfettare in modo sicuro ed efficace colture cellule simili alla microglia umana in laboratorio.
Invece, il team ha dovuto ottimizzare un LNP per svolgere il lavoro. Gli LNP hanno quattro componenti principali e, modificando le strutture di due di essi e variando il rapporto tra lipidi e RNA, i ricercatori sono stati in grado di elaborare sette formulazioni da provare. È importante sottolineare che i test hanno incluso la prova delle loro formulazioni su microglia in coltura che avevano indotto in uno stato infiammatorio. Dopotutto, quello stato è quello in cui è necessario il trattamento proposto.
Tra i sette candidati, uno del team denominato "MG-LNP" si è distinto per la sua efficienza di consegna particolarmente elevata e per la sicurezza di un carico di RNA di prova.
Ciò che funziona in una capsula a volte non funziona in un organismo vivente, quindi il team ha successivamente testato l'efficacia e la sicurezza delle formulazioni LNP nei topi. Testando due diversi metodi di iniezione, nel corpo o nel liquido cerebrospinale (CSF), hanno scoperto che l'iniezione nel liquido cerebrospinale assicurava un'efficacia molto maggiore nel colpire la microglia senza influenzare le cellule di altri organi.
Tra le sette formulazioni, MG-LNP si è rivelata ancora una volta la più efficace nella trasfezione della microglia. Langer ha affermato di ritenere che questo potrebbe potenzialmente aprire un giorno nuovi modi di trattare alcune malattie del cervello con le nanoparticelle.
Una volta saputo che l'MG-LNP poteva fornire un carico di prova alla microglia sia nelle colture di cellule umane che nei topi, gli scienziati hanno quindi testato se utilizzarlo per fornire un siRNA che sopprime PU.1 potesse ridurre l'infiammazione nelle microglia. Nelle colture cellulari, una dose relativamente bassa ha ottenuto una riduzione del 42% dell'espressione di PU.1 (il che è positivo perché le microglia hanno bisogno di almeno un po' di PU.1 per vivere).
Infatti la trasfezione di MG-LNP non ha causato alcun danno alle cellule. Ha inoltre ridotto significativamente la trascrizione dei geni che aumentano l'espressione di PU.1 nella microglia, indicando che può ridurre molteplici marcatori infiammatori.
In tutte queste e altre misure, MG-LNP ha sovraperformato un reagente disponibile in commercio chiamato RNAiMAX che gli scienziati hanno testato in parallelo.
"Questi risultati supportano l'uso del rilascio di siRNA anti-PU.1 mediato da MG-LNP come potenziale terapia per le malattie neuroinfiammatorie", hanno scritto i ricercatori.
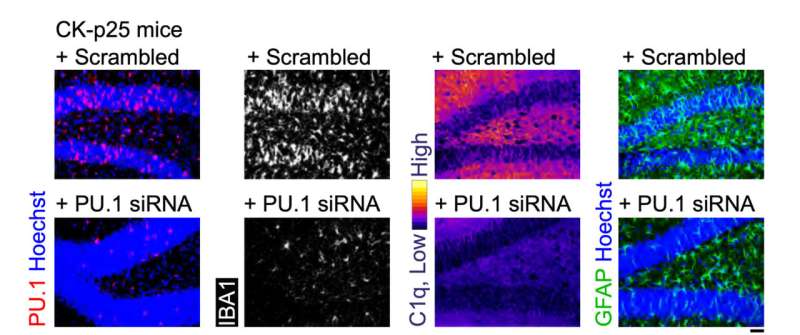
La serie finale di test ha valutato le prestazioni di MG-LNP, fornendo il siRNA in due modelli murini di infiammazione nel cervello. In uno, i topi sono stati esposti a LPS, una molecola che simula l’infezione e stimola una risposta infiammatoria sistemica. Nell'altro modello, i topi mostrano una grave neurodegenerazione e infiammazione quando un enzima chiamato CDK5 viene iperattivato da una proteina chiamata p25.
In entrambi i modelli, l'iniezione di MG-LNP che trasportano il siRNA anti-PU.1 ha ridotto l'espressione di PU.1 e dei marcatori infiammatori, proprio come nelle cellule umane in coltura.
"La somministrazione di MG-LNP di siRNA anti-PU.1 può potenzialmente essere utilizzata come terapia antinfiammatoria nei topi con infiammazione sistemica e nel modello murino CK-p25 di neuroinfiammazione simile ad AD", hanno concluso gli scienziati, definendo i risultati un "prova di principio." Saranno necessari ulteriori test prima che l'idea possa essere sperimentata su pazienti umani.
Ulteriori informazioni: William T. Ralvenius et al, Il rilascio mediato da nanoparticelle di siRNA Anti-PU.1 tramite somministrazione intracisternale localizzata riduce la neuroinfiammazione, Materiali avanzati (2023). DOI:10.1002/adma.202309225
Informazioni sul giornale: Materiali avanzati
Fornito dal Massachusetts Institute of Technology