Le nanopinzette optotermiche sono un metodo innovativo di progettazione ottica che ha rivoluzionato le tecniche ottiche classiche per catturare un'ampia gamma di nanoparticelle. Sebbene il campo di temperatura optotermico possa essere impiegato per la regolazione in situ delle nanoparticelle, rimangono sfide nell'identificare il loro potenziale per la regolazione delle bionanoparticelle.
Per osservare gli effetti sinergici della manipolazione optotermica e del biorilevamento basato su Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR), i ricercatori hanno sviluppato una combinazione di nanopinzette optotermiche alimentate da CRISPR abbreviate in CRONT.
In un nuovo rapporto in Luce:scienza e applicazioni , Jiajie Chen e un gruppo di ricerca in ingegneria optoelettronica, ingegneria biomedica e fisica, sono riusciti a raggiungere questo obiettivo sfruttando la diffusioforesi e i flussi termoosmotici per l'eccitazione optotermica arricchendo con successo nanoparticelle d'oro funzionalizzate con DNA, proteine associate a CRISPR e filamenti di DNA.
Gli scienziati si sono basati su uno schema optotermico per migliorare il rilevamento del polimorfismo a singolo nucleotide associato a CRISPR a livello di singola molecola, per introdurre un nuovo metodo basato su CRISPR per osservare la scissione dei nucleotidi. I ricercatori hanno studiato questo approccio innovativo come campo universale della diagnostica presso il punto di cura, della biofotonica e della bionanotecnologia.
Nel 1986, Arthur Ashkin ha inventato le pinzette ottiche per regolare i nanooggetti a distanza e ha ricevuto un premio Nobel per la fisica nel 2018 per questa scoperta rivoluzionaria e per il suo contributo ai sistemi biologici. Mentre le pinzette ottiche classiche dipendono dalla trasformazione della quantità di moto della luce, le combinazioni interdisciplinari di ottica plasmonica, campo elettrico e temperatura hanno efficacemente risolto i limiti.
Sono emersi numerosi approcci innovativi per offrire nuove opportunità nell'analisi e nella regolamentazione delle particelle. Le nanopinzette optotermiche utilizzano forze termodinamiche indotte otticamente per regolare le nanoparticelle su scala micrometrica con precisione submicronica.
Rispetto alle pinzette ottiche tradizionali, le pinzette optotermiche richiedono una densità di potenza inferiore, il che le rende un'alternativa interessante per il rilevamento biologico, riducendo al contempo gli effetti ottici avversi sui campioni biologici. Poiché gli effetti termici svolgono un ruolo chiave durante una varietà di processi biologici, è possibile sfruttare le capacità del campo della temperatura per applicazioni pratiche.
Il metodo può essere utilizzato per regolare le bionanoparticelle che vanno dalla micro alla nanoscala per includere batteri e cellule vive, nonché molecole e proteine di DNA a singolo e doppio filamento.
Combinazione di CRISPR con nanopinzette:CRONT
Lo stesso sistema CRISPR (Cluster Regular Interspaced Short Palindrome Repeat) offre uno straordinario strumento di editing genetico, anch'esso ricevuto un premio Nobel nel 2020. Il metodo comprendeva una proteina nucleasi associata a CRISPR e un RNA guida specifico per il DNA bersaglio.
I biofisici e i bioingegneri sono sempre più desiderosi di migliorare la sensibilità e la versatilità del rilevamento del DNA combinando il sistema CRISPR-Cas con nuove modalità di rilevamento.
Per superare i limiti esistenti del metodo, Chen e colleghi hanno progettato una piattaforma di pinzetta optotermica universalmente applicabile nota come nanopinzette optotermiche alimentate da CRISPR per identificare bionanoparticelle e hanno utilizzato la configurazione per identificare molecole di DNA in situ, senza amplificazione dell’acido nucleico. Gli esperimenti hanno fornito volumi di rilevamento ultrabassi, pari a 10 μL, per identificare polimorfismi a singolo nucleotide per studiare la diversità genetica, la suscettibilità alle malattie e la risposta ai farmaci, per soddisfare le future esigenze della ricerca genomica e della medicina.
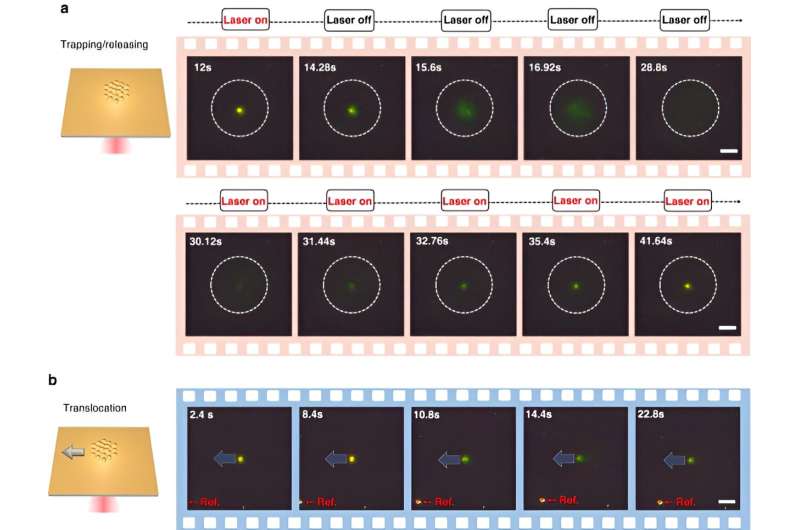
Per abilitare CRONT (nanopinzette optotermiche alimentate da CRISPR), gli scienziati hanno progettato una camera microfluidica con un sottile strato di pellicola d'oro depositata sul vetro di copertura. Quando il team ha irradiato la pellicola d’oro con l’illuminazione laser, ha generato un campo di temperatura che circondava il punto laser. Gli scienziati hanno dettagliato le condizioni ottimali delle reazioni CRISPR e hanno avviato la scissione del coniugato DNA-nanofilm d'oro, utilizzando la microscopia a campo scuro.
Hanno aggiunto un polimero non ionico di polietilenglicole (PEG) nella soluzione acquosa come tensioattivo biologico per un'eccellente biocompatibilità.
La presenza di più nanoparticelle e la loro diversa mobilità termoforetica ha generato una concentrazione di soluto distinta. Quando i soluti con concentrazioni maggiori influenzavano quelli con concentrazioni minori attraverso la pressione osmotica, i risultati risultavano in un’interazione nota come forza diffusioforetica. Questa indagine sistematica ha evidenziato il potenziale di inclusione di CRONT per condurre l'identificazione biomolecolare.
Combinazione optotermica di proteine e DNA
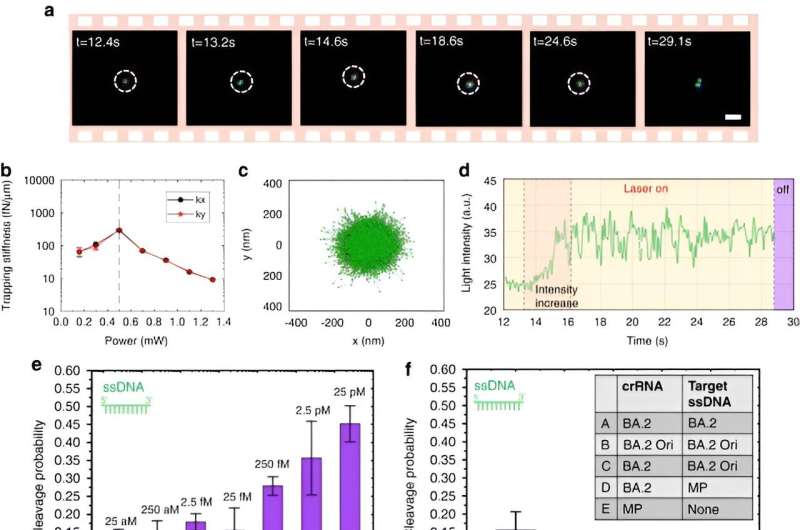
Per abilitare le nanopinzette optotermiche alimentate da CRISPR, Chen e colleghi hanno studiato i comportamenti di aggregazione di proteine e DNA utilizzando l'etichettatura a fluorescenza in cui la lunghezza dello stelo rigido generava un gradiente di concentrazione di polietilenglicole. Sebbene una potenza laser maggiore non aumentasse continuamente il tasso di accumulo a causa di un flusso termoosmotico allargato, l’accumulo di DNA a filamento singolo era maggiore rispetto a quello di DNA a doppio filamento. Mentre gli accumuli di proteine sono raramente studiati in biofisica, le proteine Cas12a marcate con fluorescenza hanno mostrato una tendenza a formare lievi accumuli ad anello, dove l'aumento della potenza del laser ha aumentato il loro tasso di accumulo.
Il team ha inoltre eseguito esperimenti su proteine comunemente incorporate come l'albumina sierica bovina con marcatura FITC. In presenza di un campo optotermico, questa distribuzione proteica è rimasta casuale e non influenzata dalla presenza di molecole di glicole polietilenico.
Chen e il team hanno notato come il campo optotermico associato alle nanopinzette optotermiche alimentate da CRISPR (CRONT), fornisse una temperatura adatta per il biorilevamento basato su CRISPR, con la capacità di arricchire le bionanoparticelle per rilevare il DNA a concentrazioni ultrabasse, invece del solo movimento browniano che è governato attraverso il rilevamento della diffusione.
Gli scienziati hanno incluso lo schema CRISPR-12a per esaminare il DNA ambientale a filamento singolo. Il sistema CRONT ha identificato con successo i DNA a livello di singola molecola per polimorfismi a singolo nucleotide con elevata sensibilità e specificità.
In questo modo, Jiajie Chen e colleghi hanno incorporato la diffusioforesi e i flussi termoosmotici nello strato limite di una pellicola optotermica reattiva per mostrare un nuovo metodo per regolare le nanopinzette optotermiche alimentate da CRISPR su scala nanometrica.
Questo metodo ha consentito l'implementazione immediata del biosensing basato su CRISPR con un volume di rilevamento ultrabasso.
Le pinzette ottiche sono dotate di identificazione del DNA tramite sistemi di biosensori basati su CRISPR come via per l'arricchimento della biomolecola per scindere il complesso CRISPR. Tali nanopinzette optotermiche o sistemi CRONT basati su CRISPR rappresentano un'enorme promessa per far avanzare la comprensione di processi biologici complessi come sonda di rilevamento versatile nella ricerca biomedica, nella scoperta di farmaci e nella diagnostica delle malattie.
Ulteriori informazioni: Jiajie Chen et al, Nanopinzette optotermiche basate su CRISPR:manipolazione di bio-nanoparticelle diverse e identificazione di singoli nucleotidi, Luce:scienza e applicazioni (2023). DOI:10.1038/s41377-023-01326-9
Informazioni sul giornale: Luce:scienza e applicazioni
© 2023 Rete Scienza X