Un team di ricercatori dell’MD Anderson Cancer Center dell’Università del Texas ha sviluppato un nuovo metodo per l’utilizzo di vescicole extracellulari per migliorare le risposte all’immunoterapia nel glioblastoma, aprendo potenzialmente la porta a un uso più ampio dell’RNA messaggero (mRNA) ingegnerizzato per la terapia del cancro. Lo studio è stato pubblicato oggi su Nature Communications.
All'inizio di quest'anno, un team di ricercatori guidati da Betty Kim, M.D., Ph.D., e Wen Jiang, M.D., Ph.D., ha sviluppato un nuovo metodo per caricare l'mRNA nelle vescicole extracellulari, piccole strutture create dalle cellule per trasportare biomolecole e acidi nucleici all'interno del corpo. L'attuale studio si basa su tale ricerca dimostrando il potenziale antitumorale delle vescicole extracellulari caricate con mRNA.
Le terapie a base di mRNA, riconosciute dal Premio Nobel per la fisiologia e la medicina 2023, hanno da tempo un potenziale rivoluzionario nelle infezioni patogene e in malattie come il cancro. Tuttavia, rimangono delle sfide per fornire con precisione l’mRNA in tutto il corpo. Per anni, gli scienziati hanno studiato potenziali meccanismi di rilascio, comprese le nanoparticelle lipidiche o polimeriche, ma ognuno di questi ha i suoi limiti.
"Ci sono due sfide principali nell'uso delle terapie mRNA per il trattamento del cancro. In primo luogo, come colpire con precisione le cellule tumorali nel corpo? In secondo luogo, come produrre una quantità sufficiente di terapia per uso umano?" Ha detto Jiang. "Il nostro approccio risolve questi due problemi."
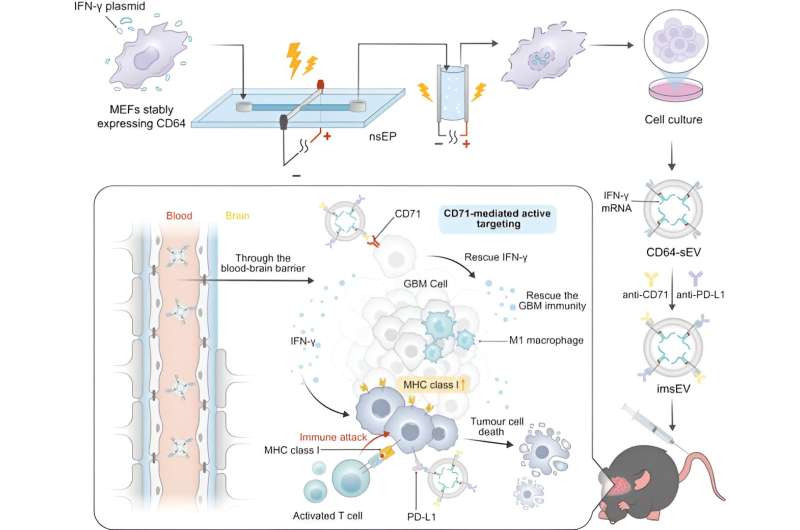
Il problema della quantità viene risolto utilizzando un sistema ad alto rendimento per produrre vescicole extracellulari caricate di mRNA da cellule ingegnerizzate. Le cellule ospiti e un plasmide progettista che codifica l'mRNA sono soggetti a due impulsi elettrici estremamente brevi, che fanno sì che le membrane all'interno della cellula, così come la membrana cellulare stessa, diventino temporaneamente permeabili. Ciò porta le cellule a secernere molte vescicole extracellulari cariche di materiale mRNA che può poi essere raccolto.
Per questo studio, i ricercatori hanno progettato le vescicole extracellulari per esprimere la proteina CD64 sulla loro superficie, che funge da meccanismo di aggancio per caricare sia gli anticorpi anti-CD71 che quelli anti-PD-L1. Una volta nel corpo, cercano CD71 e PD-L1, entrambi comunemente sovraespressi nei glioblastomi.
Queste vescicole extracellulari erano caricate con mRNA che codifica per l'interferone gamma, una proteina di segnalazione immunitaria. Quando le vescicole si legano ai recettori delle cellule tumorali, vengono internalizzate e rilasciano l'mRNA.
Uno dei motivi per cui il glioblastoma è difficile da trattare è che la downregulation di MHC-1, così come altre caratteristiche del microambiente tumorale, creano un ambiente immunosoppressivo che elude il rilevamento e limita l’efficacia delle immunoterapie. L’mRNA inverte questo processo, modificando il microambiente tumorale per rendere il tumore rilevabile dal sistema immunitario e più reattivo alle immunoterapie. Nei modelli preclinici, è stato osservato un aumento significativo del tempo di sopravvivenza e dell'attività antitumorale iniziale entro 7 giorni dall'iniezione.
"Abbiamo scelto il glioblastoma perché al momento ha opzioni terapeutiche limitate", ha detto Jiang. "Sappiamo che l'interferone gamma può indurre risposte all'immunoterapia nel glioblastoma, ma somministrarlo alle cellule tumorali si è finora rivelato una sfida importante a causa della sua emivita e dell'incapacità della maggior parte dei sistemi di somministrazione di attraversare il sangue-cervello Si spera che questi risultati aprano la strada all'utilizzo delle vescicole extracellulari caricate con mRNA nelle applicazioni contro il cancro."
Secondo Jiang, uno degli altri vantaggi di questo approccio è che è plug-and-play, il che significa che può essere adattato ad altri tumori semplicemente cambiando gli anticorpi per colpire quelli sovraespressi in altri tipi di tumore.
È in corso ulteriore lavoro preclinico per continuare a migliorare i metodi di produzione e definire il profilo della sicurezza delle vescicole extracellulari prima che vengano applicate in contesti clinici.
Ulteriori informazioni: Shiyan Dong et al, Progettazione adattiva di vescicole extracellulari caricate con mRNA per l'immunoterapia mirata del cancro, Nature Communications (2023). DOI:10.1038/s41467-023-42365-5
Informazioni sul giornale: Comunicazioni sulla natura
Fornito dal M. D. Anderson Cancer Center dell'Università del Texas