Un gruppo di ricerca guidato dal professor emerito Michio Homma (lui, lui) e dal professor Seiji Kojima (lui, lui) della Graduate School of Science dell'Università di Nagoya, in collaborazione con l'Università di Osaka e il Nagahama Institute of Bio-Science and Technology, hanno realizzato nuove conoscenze su come avviene la locomozione nei batteri.
Il gruppo ha identificato la molecola FliG nello strato flagellare, il "motore" dei batteri, e ne ha rivelato il ruolo nell'organismo. Questi risultati suggeriscono modi in cui i futuri ingegneri potrebbero costruire nanomacchine con il pieno controllo sui loro movimenti. Hanno pubblicato lo studio su iScience .
Man mano che le nanomacchine diventano più piccole, i ricercatori si ispirano agli organismi microscopici per trovare modi per farli muovere e funzionare. In particolare, il motore flagellare può ruotare in senso orario e antiorario ad una velocità di 20.000 giri al minuto. Se ingrandito, sarebbe paragonabile a un motore di Formula 1 con un’efficienza di conversione energetica quasi del 100% e la capacità di cambiare istantaneamente il senso di rotazione ad alte velocità. Se gli ingegneri riuscissero a sviluppare un dispositivo come un motore flagellare, ciò aumenterebbe radicalmente la manovrabilità e l'efficienza delle nanomacchine.
I motori flagellari dei batteri hanno un rotore e un componente stazionario che lo circonda, noto come statore. Se il flagello fosse parte di un'auto, lo statore sarebbe il motore. La rotazione dello statore viene trasmessa al rotore come un ingranaggio, facendo ruotare il rotore. A seconda della rotazione, il batterio si muove avanti o indietro, come un'auto automatica con regolazione della retromarcia e della guida. Un complesso proteico chiamato anello C controlla questo movimento.
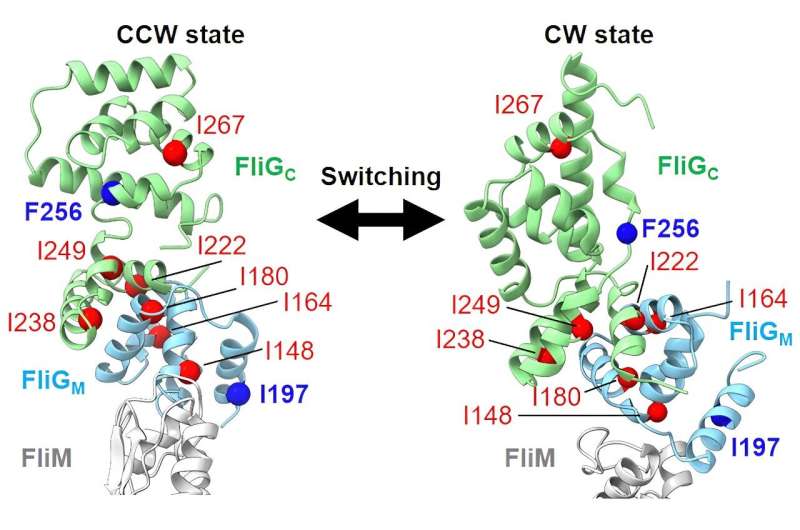
All'interno dell'anello C, la molecola FliG agisce come la frizione, passando dal movimento in avanti a quello all'indietro. Come un'auto, le parti devono funzionare insieme. Il minimo cambiamento può influenzare il motore. Nel motore flagellare, questi piccoli cambiamenti sono mutazioni. Il gruppo di Homma ha studiato il mutante G215A in FliG, che provoca la rotazione permanente in senso orario del motore, e lo ha confrontato con la forma non mutata che può muoversi sia in avanti che all'indietro.
Quando hanno testato il mutante G215A dell'organismo marino Vibrio alginolyticus, hanno scoperto che questo movimento in senso orario era dovuto ai cambiamenti in FliG e all'interazione delle molecole d'acqua attorno alla proteina. Hanno visto questi cambiamenti anche nella forma normale quando ruotava in senso orario. Tuttavia, questi differivano da quelli visti quando ruotava in senso antiorario.
"Il motore flagellare ruota in entrambe le direzioni:in senso orario per spostarsi all'indietro e in senso antiorario per andare avanti", ha detto Homma. "In questo studio, abbiamo scoperto che la struttura di FliG e l'interazione delle molecole d'acqua attorno ad esso sono diverse quando il motore si muove in senso orario e antiorario. Questa differenza consente ai batteri di passare istantaneamente dal movimento in avanti a quello all'indietro in risposta ai cambiamenti ambientali."
"Il chiarimento delle proprietà fisiche della proteina FliG nei motori rappresenta un passo avanti significativo nella nostra comprensione del meccanismo molecolare che cambia la direzione di rotazione dei motori, suggerendo modi per creare motori compatti con una maggiore efficienza di conversione energetica", ha affermato Homma. "Utilizzando questi risultati, sarà possibile progettare nanomacchine artificiali in grado di controllare liberamente la propria rotazione, cosa che dovrebbe essere applicata a vari campi futuri come la medicina e la progettazione della vita artificiale."
Ulteriori informazioni: Tatsuro Nishikino et al, I cambiamenti nella rete idrofobica del dominio FliGMC inducono la commutazione rotazionale del motore flagellare, iScience (2023). DOI:10.1016/j.isci.2023.107320
Informazioni sul giornale: iScienza
Fornito dall'Università di Nagoya