L’ingegneria cellulare può essere un potente strumento per sintetizzare cristalli proteici funzionali con promettenti proprietà catalitiche, mostrano i ricercatori della Tokyo Tech. Utilizzando batteri geneticamente modificati come piattaforma di sintesi rispettosa dell'ambiente, i ricercatori hanno prodotto catalizzatori solidi ibridi per la fotosintesi artificiale. Questi catalizzatori mostrano elevata attività, stabilità e durata, evidenziando il potenziale dell'approccio innovativo proposto.
I cristalli proteici, come i cristalli normali, sono strutture molecolari ben ordinate con proprietà diverse e un enorme potenziale di personalizzazione. Possono assemblarsi naturalmente a partire dai materiali presenti all'interno delle cellule, il che non solo riduce notevolmente i costi di sintesi ma diminuisce anche il loro impatto ambientale.
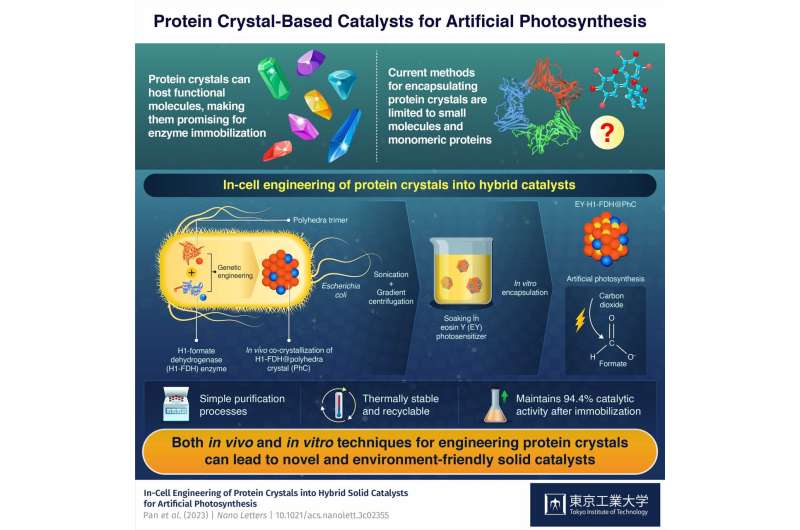
Sebbene i cristalli proteici siano promettenti come catalizzatori perché possono ospitare varie molecole funzionali, le tecniche attuali consentono solo l’attacco di piccole molecole e proteine semplici. Pertanto, è imperativo trovare modi per produrre cristalli proteici contenenti sia enzimi naturali che molecole funzionali sintetiche per sfruttare il loro pieno potenziale di immobilizzazione degli enzimi.
In questo contesto, un team di ricercatori del Tokyo Institute of Technology (Tokyo Tech) guidato dal professor Takafumi Ueno ha sviluppato una strategia innovativa per produrre catalizzatori solidi ibridi basati su cristalli proteici. Come spiegato nel loro articolo pubblicato su Nano Letters il 12 luglio 2023, il loro approccio combina l'ingegneria in cella e un semplice processo in vitro per produrre catalizzatori per la fotosintesi artificiale.
L'elemento costitutivo del catalizzatore ibrido è un monomero proteico derivato da un virus che infetta il baco da seta Bombyx mori. I ricercatori hanno introdotto il gene che codifica per questa proteina nei batteri Escherichia coli, dove i monomeri prodotti formavano trimeri che, a loro volta, si assemblavano spontaneamente in cristalli di poliedri stabili (PhC) legandosi tra loro attraverso la loro α-elica N-terminale (H1 ).
Inoltre, i ricercatori hanno introdotto una versione modificata del gene della formiato deidrogenasi (FDH) di una specie di lievito nel genoma dell'E. coli. Questo gene ha indotto i batteri a produrre enzimi FDH con terminali H1, portando alla formazione di cristalli ibridi H1-FDH@PhC all'interno delle cellule.
Il team ha estratto i cristalli ibridi dai batteri E. coli mediante sonicazione e centrifugazione in gradiente e li ha immersi in una soluzione contenente un fotosensibilizzatore artificiale chiamato eosina Y (EY). Di conseguenza, i monomeri proteici, che erano stati geneticamente modificati in modo tale che il loro canale centrale potesse ospitare una molecola di eosina Y, facilitavano il legame stabile di EY al cristallo ibrido in grandi quantità.
Attraverso questo processo ingegnoso, il team è riuscito a produrre catalizzatori EY·H1-FDH@PhC altamente attivi, riciclabili e termicamente stabili in grado di convertire l'anidride carbonica (CO2 ) in formato (HCOO − ) dopo l'esposizione alla luce, imitando la fotosintesi. Inoltre, hanno mantenuto il 94,4% della loro attività catalitica dopo l'immobilizzazione rispetto a quella dell'enzima libero.
"L'efficienza di conversione del cristallo ibrido proposto era di un ordine di grandezza superiore a quella dei composti precedentemente riportati per la fotosintesi artificiale enzimatica basata su FDH", afferma il prof. Ueno. "Inoltre, il PhC ibrido è rimasto nello stato di assemblaggio proteico solido dopo aver sopportato processi di ingegneria sia in vivo che in vitro, dimostrando la notevole capacità di cristallizzazione e la forte plasticità dei PhC come scaffold incapsulanti."
Nel complesso, questo studio mette in mostra il potenziale della bioingegneria nel facilitare la sintesi di materiali funzionali complessi. "La combinazione di tecniche in vivo e in vitro per l'incapsulamento dei cristalli proteici fornirà probabilmente una strategia efficace e rispettosa dell'ambiente per la ricerca nei settori dei nanomateriali e della fotosintesi artificiale", conclude il prof. Ueno.
Ulteriori informazioni: Tiezheng Pan et al, Ingegneria in-cell di cristalli proteici in catalizzatori solidi ibridi per la fotosintesi artificiale, Nano lettere (2023). DOI:10.1021/acs.nanolett.3c02355
Informazioni sul giornale: Nanolettere
Fornito dal Tokyo Institute of Technology