Molte malattie possono essere curate con successo nel semplice ambiente di una piastra di coltura cellulare, ma per curare con successo persone reali, l’agente farmaceutico deve intraprendere un viaggio attraverso l’ambiente infinitamente più complesso all’interno del nostro corpo e arrivare, intatto, all’interno delle cellule colpite. Questo processo, chiamato somministrazione di farmaci, è uno degli ostacoli più significativi in medicina.
Una collaborazione tra il Lawrence Berkeley National Laboratory (Berkeley Lab) e Genentech, un membro del gruppo Roche, sta lavorando per superare alcuni dei colli di bottiglia nella somministrazione dei farmaci progettando le nanoparticelle lipidiche (LNP) più efficaci:minuscoli sacchetti sferici costituiti da molecole di grasso che incapsulano gli agenti terapeutici finché non si agganciano alle membrane cellulari e rilasciano il loro contenuto. Il primo farmaco che utilizza gli LNP è stato approvato nel 2018, ma il metodo di somministrazione è diventato famoso a livello globale con i vaccini COVID mRNA di Pfizer e Moderna.
"È un sistema piuttosto intelligente, perché se si fornisce semplicemente l'RNA stesso al corpo umano, l'RNA viene degradato dalle nucleasi e non può attraversare facilmente la membrana cellulare a causa delle sue dimensioni e della sua carica, ma gli LNP lo trasportano in modo sicuro nella cellula, " ha spiegato il co-autore principale Chun-Wan Yen, uno scienziato principale senior del gruppo Small Molecule Pharmaceutical Sciences di Genentech.
Gli LNP vengono ora ampiamente esplorati come sistema di somministrazione di vaccini per altre malattie infettive o vaccini terapeutici per il cancro. La fattibilità di queste nuove applicazioni dipenderà da quanto bene gli involucri lipidici si fondono con le cellule bersaglio, da quanto stabili sono le formulazioni farmaco-LNP durante lo stoccaggio (in modo che abbiano una lunga durata di conservazione) e da quanto sono stabili nel corpo. (quindi possono conferire un'attività farmacologica prolungata).
Tutte queste proprietà sono controllate dalla miscela di molecole utilizzate per creare l'LNP e dalla risultante struttura 3D della particella. Il team guidato da Yen e dagli altri co-responsabili Greg Hura e Michal Hammel, entrambi biofisici del Berkeley Lab, studia da diversi anni come ottimizzare la struttura degli LNP per le proprietà desiderate.
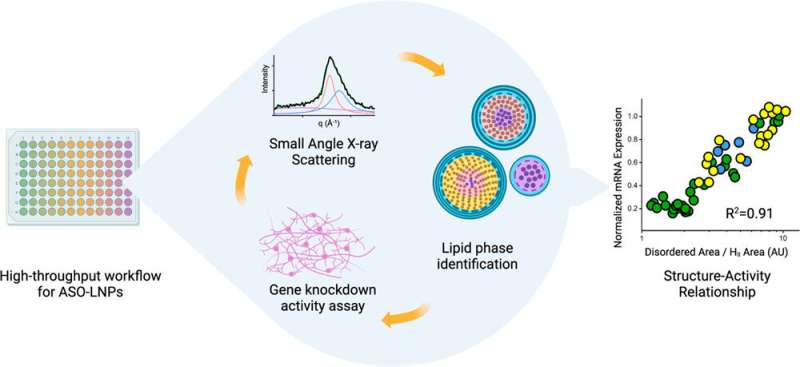
Il loro ultimo articolo, pubblicato di recente su ACS Nano , documenta come un flusso di lavoro ad alto rendimento consente loro di produrre e caratterizzare LNP a velocità record. Lo studio include anche la prima dimostrazione in assoluto di come la struttura dell'LNP sia correlata all'attività del suo contenuto, che per questa indagine era un oligonucleotide antisenso (ASO). Gli ASO sono piccoli frammenti di coppie di basi di RNA o DNA che bloccano l'espressione genica legandosi a filamenti di mRNA e impedendo loro di essere tradotti in proteine. Gli ASO sono un ottimo modo per trattare le malattie causate da proteine difettose o dalla sovrabbondanza di una proteina. Ma, come l'mRNA, sono sensibili alle nucleasi vaganti (enzimi che degradano l'RNA e il DNA) e le cellule non li assorbono prontamente.
Gli scienziati hanno scoperto che gli LNP che trasportano ASO con strutture interne ben ordinate e fitte hanno portato a un migliore silenziamento di un gene difettoso nei neuroni umani associato a una malattia degenerativa, rispetto agli LNP che avevano una struttura più disordinata. I risultati provengono da attività cellulari, non da studi sugli animali, quindi c'è ancora molto lavoro da fare, ma il team è entusiasta di sviluppare queste informazioni utilizzando gli strumenti complementari di ciascuna istituzione.

"Generiamo gli LNP ad alto rendimento e il team di Greg e Michal può offrire l'analisi ad alto rendimento", ha affermato Yen. "Se controlli la pubblicazione oggigiorno, in genere fanno solo una o due formulazioni, ma per noi è diverso. Possiamo generare set di dati di grandi dimensioni e penso che sia il motivo per cui possiamo avere questa scoperta davvero unica e interessante."
"Questo documento definisce realmente il metodo che applicheremo alle migliaia di altre formulazioni che intendiamo caratterizzare", ha aggiunto Hura, che fa parte dell'area Bioscienze del Berkeley Lab. "Speriamo che questo diventi un metodo generale per consentire alle persone di ottimizzare le loro nanoparticelle lipidiche. Che si tratti di vaccini, e ancora una volta, i vaccini hanno ricevuto la massima attenzione finora, o oltre. Questo tipo di terapia ha un'applicazione molto ampia oltre a ciò. ."
Le strutture degli LNP sono influenzate dal modo in cui li mescoli, da cosa mescoli insieme e in quale ordine. Gli LNP hanno quattro ingredienti:lipidi ionizzabili, fosfolipidi helper, colesterolo e polietilenglicole-lipidi (lipidi PEG) e ciascun ingrediente ha forme diverse. Inoltre, possono essere combinati in diversi rapporti, portando a un numero esponenziale di possibili formule. A complicare ulteriormente le cose, gli LNP cambiano nel tempo. Una formulazione che inizia come una sfera ordinata e compatta alla fine si trasformerà in una struttura più disordinata.
Gli scienziati della Genentech hanno sviluppato un flusso di lavoro guidato da robot in grado di generare centinaia di formulazioni LNP in poche ore. I campioni di ciascuna formulazione vengono poi portati al Berkeley Lab per eseguire lo scattering di raggi X a piccolo angolo (SAXS) presso l'Advanced Light Source, un acceleratore di particelle circolare che crea fasci di raggi X di diverse energie.
La linea di luce biologica SAXS può elaborare rapidamente molti campioni e, a differenza di altre forme di diffrazione di raggi X su materiali biologici, i campioni non necessitano di essere congelati o cristallizzati, il che potrebbe modificare la struttura degli LNP e impedire agli scienziati di scoprire cosa Gli LNP apparirebbero alle temperature fisiologiche del corpo umano. SAXS consente inoltre di acquisire istantanee di LNP in punti temporali specifici per determinarne la longevità strutturale.
Inoltre, il team di Genentech utilizza un processo accelerato per studiare come gli LNP influenzano l’espressione genetica nelle loro cellule bersaglio. Combinando tutte queste tecniche accelerate, l'intera collaborazione è in grado di selezionare potenziali LNP a un ritmo senza precedenti.
Yen prevede di continuare a utilizzare la linea di luce SAXS per studiare piccoli dettagli, come il modo in cui una variazione dell'1% nella concentrazione degli ingredienti o l'utilizzo di una nuova macchina durante la produzione può influenzare l'attività cellulare degli LNP, nonché grandi domande, come se gli LNP si comportano diversamente se sono trasportano altri tipi di carico e come interagiscono con le diverse celle bersaglio.
"Sappiamo che gli LNP di mRNA funzionano, ma c'è ancora un enorme divario di conoscenze", ha detto Yen. "Ecco perché ritengo che il nostro articolo sia un pioniere in questo campo e speriamo di poter anche generare più dati e conoscenze per le applicazioni future."
Ulteriori informazioni: Michal Hammel et al, Correlazione della struttura e dell'attività di silenziamento genico di nanoparticelle lipidiche caricate con oligonucleotidi utilizzando la diffusione di raggi X a piccolo angolo, ACS Nano (2023). DOI:10.1021/acsnano.3c01186
Informazioni sul giornale: ACS Nano
Fornito dal Lawrence Berkeley National Laboratory