Credito:Wiley
I tassi di conversione straordinariamente elevati degli enzimi naturali derivano in parte dall'aumento dell'attività catalitica di alcune catene laterali selezionate di amminoacidi attraverso il posizionamento preciso all'interno della cavità di legame proteico. Gli scienziati hanno ora dimostrato che tale messa a punto è possibile anche per gli enzimi "designer" con amminoacidi catalitici non naturali. Nel diario Angewandte Chemie , riferiscono che l'"evoluzione" di laboratorio di un enzima designer con una catena laterale di anilina ha portato a varianti con attività significativamente più elevata.
La velocità e la selettività con cui gli enzimi in natura catalizzano le conversioni sono invidiabili. Per potenziare cataliticamente le reazioni innaturali, i ricercatori imitano gli enzimi con l'aiuto di strutture proteiche realizzate mediante la progettazione assistita da proteine. Un'ulteriore ottimizzazione si ottiene attraverso la ripetizione di un ciclo darwiniano:1) diversificazione attraverso la mutazione, 2) identificazione di catalizzatori migliorati, e 3) amplificazione delle varianti enzimatiche più efficienti. Ciò consente la produzione di enzimi designer con attività molto elevate.
I ricercatori guidati da Clemens Mayer e Gerard Roelfes dell'Università di Groningen (Paesi Bassi) hanno ora dimostrato che questo tipo di evoluzione diretta è anche un metodo per migliorare l'efficienza di una nuova classe di enzimi designer:enzimi che contengono un amminoacido che è non utilizzato dalla natura.
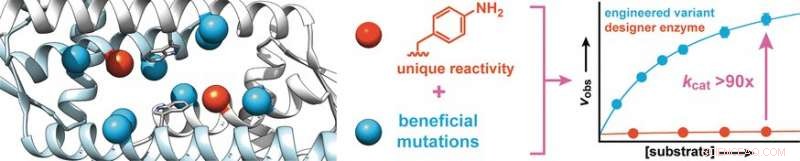
Partendo da una proteina del Lactococcus lactis, un batterio utilizzato nella produzione di prodotti lattiero-caseari come formaggio e latticello, i ricercatori hanno sintetizzato un enzima di design che contiene un amminoacido con una catena laterale di anilina abiotica (aminofenilalanina). Come l'anilina libera, questo amminoacido catalizza la reazione delle aldeidi con idrazine o idrossilammine per produrre idrazoni o ossime, rispettivamente.
Per aumentare l'attività dell'enzima, i ricercatori hanno prodotto varianti enzimatiche con mutazioni negli amminoacidi vicino alla catena laterale dell'anilina. Lo screening di circa 400 mutanti ha prodotto due candidati con una migliore attività, uno dei quali è stato sottoposto a un secondo ciclo evolutivo. Ciò ha portato alla scoperta di mutazioni più benefiche. Per identificare gli effetti sinergici, più mutazioni favorevoli sono state combinate per produrre ulteriori varianti. In questo modo, è stato possibile aumentare il tasso di conversione dell'enzima di un fattore 90.
I ricercatori sottolineano che, simile agli enzimi naturali, "questo drastico aumento si basa sul rafforzamento dell'attività catalitica intrinseca della catena laterale dell'anilina. Intendiamo utilizzare questo principio per incorporare ulteriori catalizzatori organici come catene laterali negli enzimi, e utilizzare l'evoluzione diretta per convertirli in enzimi designer altamente efficaci in grado di eseguire rapidamente ed efficientemente reazioni sinteticamente importanti che altrimenti si svolgerebbero solo molto lentamente".