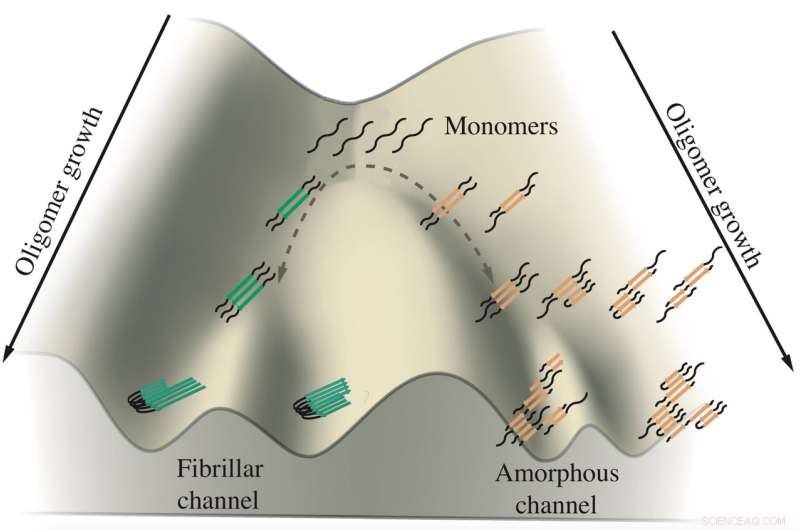
Uno schema mostra la crescita degli oligomeri tau implicati nell'Alzheimer e nelle malattie di Pick. I monomeri di tau tendono ad aggregarsi lungo due canali, uno porta a fibrille che formano grovigli e l'altro porta a grumi amorfi nei neuroni. I ricercatori della Rice University hanno simulato le proteine in modelli computazionali per vedere come e dove avviene la ramificazione. Credito:Centro di fisica biologica teorica
Nuove simulazioni degli scienziati della Rice University raccontano una storia di due tau e di come si relazionano alle malattie neurologiche.
Il loro lavoro suggerisce che le proteine tau prendano uno dei due percorsi per formare aggregati sospettati di promuovere, e forse causando, Malattie di Alzheimer e di Pick (aka demenza frontotemporale). Proprio perché rimane un mistero, ma capirlo offre la possibilità di controllare i loro destini.
proteine tau, soprattutto nei neuroni, regolano principalmente i microtubuli, i filamenti che fungono da strade per il carico all'interno di una cellula e facilitano la divisione. Ma vengono in molte forme e, come risulta, questi possono aggregarsi in modi distinti.
Lo studio del biofisico Peter Wolynes e del suo team nel Atti dell'Accademia Nazionale delle Scienze è la prima analisi computazionale a tracciare una distinzione tra proteine che formano o le fibrille solide che si trovano nel cervello dei pazienti con Alzheimer e Pick o quelle disordinate, ciuffi simili a tumbleweed che galleggiano nel citoplasma dei neuroni.
"C'è una relazione tra la forma che si trasforma in organelli senza membrana (i tumbleweeds) e la forma che diventa fibre, " disse Wolynes, un condirettore del Centro di Fisica Biologica Teorica di Rice. "Sembra che ci siano due percorsi distinti che la stessa molecola di tau può seguire, e l'equilibrio tra i due percorsi è influenzato da qualche processo biologico."
Ha detto che i modelli suggeriscono che la fosforilazione, che regola molti processi di segnalazione cellulare, può essere il fattore determinante.
"Una volta scoperto quale di questi aggregati è il vero cattivo, allora dovrebbe essere possibile intervenire in dire, il processo di fosforilazione stesso al fine di modificare l'equilibrio, "Ha detto Wolynes.
Il laboratorio di riso ha utilizzato il suo AWSEM a grana grossa (memoria associativa, mediato dall'acqua, struttura e modello energetico) strumento di analisi, che predice come le proteine si ripiegano, su una varietà di modelli di proteine tau basati su varianti dei pazienti. Hanno scoperto che la formazione delle fibre può essere manipolata dalla fosforilazione che si verifica in una moltitudine di siti nella proteina tau.
"Abbiamo scoperto che la fosforilazione ha incoraggiato la formazione dell'aggregato amorfo, ma non ha incoraggiato la formazione della fibra, di tanto, comunque, "Ha detto Wolynes.
Anche la fosforilazione può andare fuori dai binari, Egli ha detto. "Ci sono qualcosa come 20 siti lungo la proteina tau che possono essere fosforilati, ma in generale, solo quattro o cinque di loro sono, " disse Wolynes. "Ma a volte, sono diventati iperfosforilati, il che significa che gli enzimi responsabili del processo fanno di più. finiscono con, dire, 10 siti fosforilati invece di cinque, e questo potrebbe avere qualche effetto.
"Se la fosforilazione extra può causare più malattia, vorremmo scoprire quali chinasi fanno la fosforilazione e cercare di inibirle con un farmaco, come facciamo nel trattamento del cancro, " Egli ha detto.
Le proteine tau hanno mostrato un'altra caratteristica interessante chiamata backtracking, che i ricercatori hanno visto nei peptidi beta amiloidi che sono anche implicati nell'Alzheimer. Entrambi tendono ad aggregarsi fino a quando le barriere energetiche li costringono a dispiegarsi parzialmente e quindi cercano un altro percorso verso il loro finale, forme più stabili.
È a quel punto di frustrazione che l'aggregazione di taus sembra ramificarsi in direzioni diverse, ha detto Wolynes. Un insieme di tau forma fibrille parallele che si aggregano nelle placche ordinate osservate nel cervello dei pazienti, mentre l'altro si aggrega liberamente nel grumo galleggiante. I ricercatori hanno suggerito che il meccanismo di backtracking potrebbe essere una caratteristica universale dell'aggregazione proteica, un argomento di studio futuro.
Gli aggregati sciolti presentano le proprie sfide agli scienziati, ha detto Wolynes.
"Sono una questione di fisica nel seguente senso:sono oggetti localizzati, ma perché non si illuminano tutti insieme e formano un enorme organello, come quello che succede con le gocce d'olio nell'acqua?" disse. "È solo che impiegano troppo tempo per muoversi? È che vengono costantemente fatti e smontati? E cosa determina la loro dimensione?
"A questo punto, è ancora una storia molto elementare e abbastanza semplice, " ha detto Wolynes. "La vera storia di tau è ancora troppo complicata per noi, ma quello che abbiamo imparato finora è abbastanza semplice."