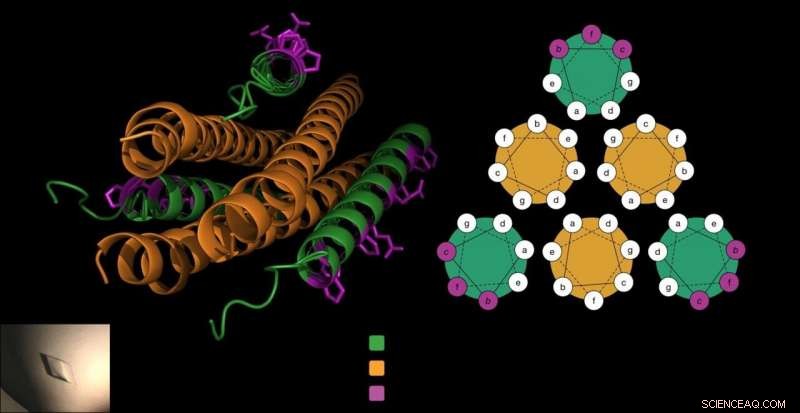
Il peptide antivirale è composto da tre cavatappi (in verde), che si bloccano attorno alla proteina di fusione del virus (in arancione) per impedire al virus di entrare nelle cellule. Il laboratorio Gellman ha aggiunto beta amminoacidi unici al peptide (in viola) in un modo che non interferiva con questa interazione cruciale e rendeva il peptide più stabile. Credito:Victor Fuorilegge.
Progettando una piccola porzione di proteine, o peptide, che può prevenire l'attaccamento dei virus parainfluenzali umani alle cellule, i ricercatori hanno migliorato un metodo nei modelli di roditori destinato a mantenere i bambini sani.
virus parainfluenzali umani, o HPIV, sono la principale causa di infezioni respiratorie infantili, responsabile dal 30% al 40% di malattie come la groppa e la polmonite. I virus colpiscono anche gli anziani e le persone con un sistema immunitario compromesso.
per far ammalare le persone, Gli HPIV devono attaccarsi alle cellule e iniettare il loro materiale genetico per iniziare a produrre nuovi virus. HPIV3 è il più diffuso tra questi virus. Attualmente non ci sono vaccini o antivirali approvati per l'infezione da HPIV3 nelle persone.
In uno studio condotto dal laboratorio Sam Gellman nel dipartimento di chimica dell'Università del Wisconsin-Madison, e il laboratorio di Anne Moscona e Matteo Porotto alla Columbia University, i ricercatori hanno costruito anni di lavoro sui trattamenti peptidici per generarne uno in grado di bloccare il processo di attaccamento dell'HPIV3.
I ricercatori hanno pubblicato i loro risultati il 7 aprile nel Giornale della Società Chimica Americana .
Per entrare nelle cellule ospiti, Gli HPIV utilizzano proteine di fusione specializzate che assomigliano a tre cavatappi posti uno accanto all'altro. Il lavoro precedente del laboratorio Moscona-Porotto ha mostrato che gli scienziati potrebbero un pezzo parziale di questa proteina cavatappi da HPIV3, introdurre questo peptide nel virus, e impedire al cavatappi di guidare il processo di infezione. Il peptide, esso stesso un cavatappi, essenzialmente si chiude con i cavatappi del virus, creando un fascio stretto di sei forme di cavatappi.
Il nuovo peptide persiste più a lungo nel corpo, rendendolo circa tre volte più efficace nel bloccare l'infezione nei modelli di malattia dei roditori rispetto alla forma originale.
Il team di ricerca ha iniziato cercando di progettare il peptide originale in modo che fosse più resistente agli enzimi che digeriscono le proteine nel corpo, che possono facilmente distruggere le proteine e renderle inutili. Così, il laboratorio Gellman si è rivolto a elementi costitutivi insoliti per creare un peptide più resistente.
Le cellule costruiscono le proteine dagli alfa amminoacidi. Ma i chimici possono creare amminoacidi beta, che sono simili ma hanno un atomo di carbonio in più. Quando i peptidi utilizzano questi elementi costitutivi di beta amminoacidi, spesso prendono una forma diversa a causa dell'atomo in più. Questo può aiutare un peptide a nascondersi dagli enzimi che digeriscono le proteine e a sopravvivere più a lungo.
Però, i ricercatori sapevano anche che se la forma del peptide cambiava troppo a causa di questi insoliti elementi costitutivi, potrebbero non bloccarsi insieme alla proteina di fusione del cavatappi di HPIV.
È qui che i decenni di esperienza del laboratorio Gellman nel testare e modificare i peptidi contenenti amminoacidi beta sono diventati fondamentali.
"Sappiamo quale lato del peptide si lega al suo bersaglio proteico. Quindi, noi (sapevamo di noi) possiamo modificare solo i residui che non sono direttamente coinvolti nel legame della proteina virale, "dice Victor Fuorilegge, un ricercatore post-dottorato in laboratorio e uno dei co-primi autori del rapporto. Nei test di laboratorio, hanno visto che il peptide accuratamente modificato si legava ancora fortemente alla proteina del virus.
In un altro miglioramento introdotto dal laboratorio Moscona-Porotto, gli scienziati hanno collegato il peptide a una molecola di colesterolo. Questa aggiunta di grassi aiuta il peptide a scivolare nella membrana cellulare grassa, dove può bloccare al meglio il virus.
"La nostra ipotesi era che la combinazione di beta aminoacidi e colesterolo avrebbe aumentato l'efficacia antivirale, "dice fuorilegge, che ha spiegato che il colesterolo ha aiutato a portare il peptide dove doveva andare, mentre il cambiamento di forma dai beta amminoacidi ha permesso al peptide di persistere più a lungo nel corpo.
Come sperava il team di ricerca, quando hanno dato il nuovo peptide ai ratti di cotone è durato molto più a lungo nei polmoni rispetto alla versione precedente grazie alla sua resistenza alla digestione da parte degli enzimi. Il peptide è stato consegnato nel naso dei ratti.
Per testare quanto bene ha funzionato il peptide per prevenire l'infezione, ratti di cotone hanno ricevuto il nuovo peptide prima di essere esposti a HPIV3. Rispetto agli animali a cui non sono stati dati peptidi antivirali, quelli a cui era stato somministrato il peptide migliorato avevano 10 volte meno virus nei polmoni.
E rispetto al peptide che era più suscettibile agli enzimi, il peptide più resistente ha ridotto la carica virale di circa tre volte, suggerendo che la capacità del nuovo peptide di evitare la digestione nel corpo lo aiuta a bloccare meglio le infezioni.
Sebbene l'approccio non sia ancora stato testato sugli esseri umani e i ricercatori devono ulteriormente perfezionare e testare il sistema, fornisce una nuova strategia per prevenire o trattare potenzialmente queste infezioni comuni.
La collaborazione di ricerca sta ora cercando di produrre peptidi di seconda generazione che durino ancora più a lungo nel corpo. Vogliono anche testare quanto bene il peptide modificato possa bloccare l'infezione da virus correlati. Questa ricerca aggiuntiva potrebbe avvicinare il trattamento peptidico agli studi clinici.
"Questo è stato un incontro molto fortunato di gruppi che avevano bisogni e capacità complementari, " dice Gellman. "È stato davvero un grande sforzo congiunto".