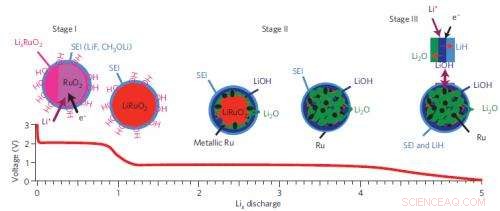
Un riassunto del percorso di reazione a tre stadi del sistema di batterie al rutenio-ossido-litio.
Le batterie agli ioni di litio (Li) alimentano quasi tutti i dispositivi elettronici portatili che usiamo ogni giorno, compresi gli smartphone, macchine fotografiche, giocattoli, e persino auto elettriche. I ricercatori di tutto il mondo stanno lavorando per trovare materiali che portino a soluzioni sicure, a buon mercato, di lunga durata, e potenti batterie agli ioni di litio.
Lavorando in varie strutture per sorgenti luminose del Dipartimento dell'Energia degli Stati Uniti e nelle università di Cambridge e Stony Brook, un gruppo di ricercatori ha recentemente studiato una classe di elettrodi per batterie agli ioni di litio che hanno capacità molto maggiori di quelle dei materiali utilizzati nelle batterie odierne. I ricercatori volevano determinare perché questi materiali possono spesso immagazzinare più carica di quanto predetto dalla teoria.
Gli autori hanno scelto l'ossido di rutenio (RuO2) come sistema modello per studiare questi cosiddetti "materiali di conversione, " chiamato perché subiscono grandi cambiamenti strutturali quando reagiscono con gli ioni di litio, formando reversibilmente nanoparticelle metalliche e sali (qui Ru e Li2O). Queste reazioni sono molto diverse da quelle che si verificano negli elettrodi convenzionali, che immagazzinano carica consentendo agli ioni di litio di annidarsi negli spazi all'interno del reticolo cristallino.
"La nostra indagine ha identificato la fonte della capacità aggiuntiva trovata per RuO2, e ha anche prodotto un protocollo per studiare lo "strato di passivazione" che si forma sugli elettrodi della batteria, che protegge l'elettrolita dal subire ulteriori reazioni di decomposizione nei successivi cicli di carica-scarica, " ha detto il ricercatore corrispondente dello studio, Chiara Grigia, professore nei dipartimenti di chimica delle università di Cambridge e Stony Brook. "Comprendere le strutture di questi strati di passivazione è la chiave per realizzare batterie che durino abbastanza a lungo da poter essere utilizzate in applicazioni come il trasporto e l'immagazzinamento nella rete elettrica".
Alla sorgente di luce di sincrotrone nazionale del Brookhaven National Laboratory, il team ha studiato i campioni utilizzando la struttura vicino al bordo di assorbimento dei raggi X (XANES) e la struttura fine di assorbimento dei raggi X estesa (EXAFS). All'Advanced Photon Source dell'Argonne National Laboratory, hanno usato due tecniche aggiuntive, diffrazione di raggi X ad alta risoluzione (XRD) e analisi della funzione di distribuzione della coppia di scattering (PDF), per estrarre informazioni sui cambiamenti strutturali elettronici e a lungo/corto raggio dell'elettrodo RuO2 in tempo reale mentre la batteria è stata scaricata e caricata. Utilizzando questi metodi, il team ha dimostrato che RuO2 è stato ridotto a nanoparticelle di Ru e Li2O attraverso la formazione di fasi intermedie, LixRuO2.
Poiché ciò non spiegava l'origine del meccanismo di accumulo di addebiti aggiuntivo, il gruppo ha usato un'altra tecnica, risonanza magnetica nucleare (NMR) allo stato solido ad alta risoluzione. Questo metodo prevede di sottoporre un campione a un campo magnetico e misurare la risposta dei nuclei all'interno del campione. Può fornire informazioni specifiche sulle composizioni chimiche e sulle strutture locali, ed è particolarmente utile per studiare composti che contengono solo elementi "leggeri", come l'idrogeno (H), Li, e ossigeno (O), che sono difficili da rilevare utilizzando XRD. I dati NMR hanno mostrato che il maggior contributo alla capacità è la formazione di LiOH, che converte reversibilmente in Li2O e LiH. Contribuenti minori alla capacità provengono dallo stoccaggio di Li sulle superfici delle nanoparticelle Ru, formando una lega LixRu, e la decomposizione dell'elettrolita. Quest'ultimo, però, alla fine fa diminuire la capacità e provocherà la morte della batteria dopo più cicli di carica.