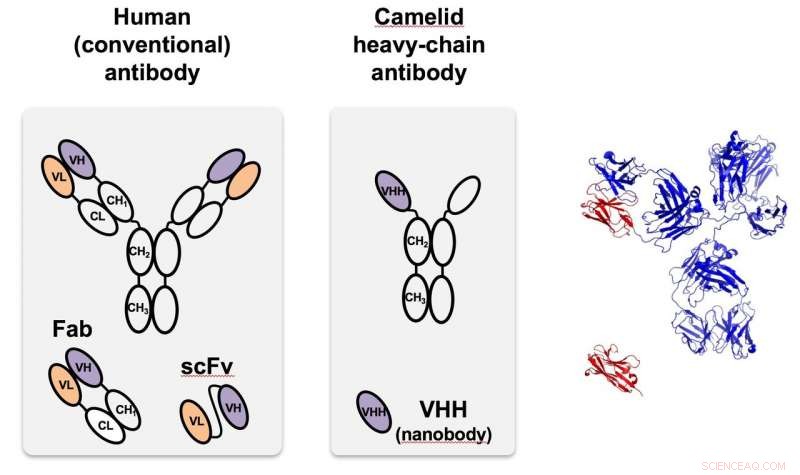
Il nanobody camelide (al centro), identificato per la prima volta nei cammelli, è un anticorpo a catena pesante che è molto più piccolo e più facile da programmare rispetto agli anticorpi presenti nella maggior parte degli organismi, compresi gli umani, così a sinistra. A destra, il camelide monomerico (rosso) viene confrontato con la struttura dell'anticorpo umano a grandezza naturale. VHH è un nanobody progettato per colpire le proteine fluorescenti verdi utilizzate nei test di prova di principio presso la Rice. Credito:Segatori Research Group/Rice University
Un anticorpo su nanoscala trovato per la prima volta nei cammelli combinato con una molecola che degrada le proteine è una nuova piattaforma efficace per controllare i livelli di proteine nelle cellule, secondo gli scienziati della Rice University. La tecnica potrebbe aiutare la ricerca fondamentale sulla dinamica cellulare e la progettazione di circuiti genetici sintetici.
Ingegnere chimico e biomolecolare del riso Laura Segatori, l'ex studente laureato Wenting Zhao e l'ex studente universitario Lara Pferdehirt hanno inventato un sistema di riconoscimento bifunzionale che chiamano NanoDeg. Consente loro di indirizzare proteine specifiche in una cellula e di regolare rigorosamente la loro degradazione.
Il sistema plug-and-play consentirà ai biologi sintetici di studiare la funzione di una specifica proteina all'interno dell'ambiente cellulare valutando come il livello di espressione della proteina influisce sulla vita di una cellula, disse Segatori.
La ricerca appare sulla rivista American Chemical Society Biologia sintetica ACS .
NanoDeg accelera la proteolisi, la scomposizione enzimatica delle proteine, per controllare i livelli delle proteine bersaglio dopo la traduzione.
Una funzione scaturisce dall'anticorpo a catena singola dei camelidi, che può essere personalizzato per indirizzare proteine specifiche. Quando gli anticorpi furono scoperti nei cammelli (e in seguito negli squali), i ricercatori hanno rapidamente riconosciuto le loro proprietà uniche, comprese le loro piccole dimensioni, elevata solubilità e capacità di riconoscere anche bersagli nascosti o in stati intermedi. Sono molto più piccoli degli anticorpi che si trovano naturalmente negli esseri umani e nella maggior parte degli altri organismi, ma possono essere facilmente prodotti e modificati nei batteri e in altre cellule.
L'altra funzione si basa su degrons, brevi sequenze nelle proteine responsabili della regolazione della velocità di degradazione di una proteina. Questi possono anche essere personalizzati per regolare l'esaurimento di una proteina bersaglio ai livelli desiderati.
Se combinati come NanoDegs, diventano potenti, piattaforma universale per modulare i livelli di proteine cellulari, disse Segatori.
"Essenzialmente, ci permette di controllare la quantità specifica di proteine nelle cellule, " ha detto. "Possiamo adattarlo a qualsiasi proteina in una cellula, e una volta che il nanobody etichettato con degron si lega a quel partner, l'intero complesso è degradato.
"Il vantaggio di questo sistema è che mira all'espressione a livello di proteine, "Segatori ha detto. "In genere, quando le persone vogliono modulare la quantità di proteine nelle cellule, agiscono a livello del DNA o dell'RNA, il livello genetico. Ma agendo a livello proteico, possiamo indirizzare diverse modifiche post-regolamento, e, cosa molto più importante, abbiamo molto più controllo sulla velocità e sull'entità dell'esaurimento della proteina".
Come prova di principio, i ricercatori hanno progettato un circuito genetico sintetico che esprimeva sia la proteina fluorescente verde (GFP), che i ricercatori usano per riferire sui processi cellulari, e un NanoDeg che lo prende di mira. "Abbiamo usato GFP perché è un reporter comunemente usato e la fluorescenza è facile da misurare, " ha detto Segatori. "Quando il nanobody riconosce GFP, l'intero complesso è preso per degrado."
Sarà utile anche a coloro che desiderano informazioni più pulite sulle attività delle proteine nelle cellule.
"Supponiamo di progettare un circuito genetico in cui l'espressione della GFP viene attivata quando la cellula è sotto stress, come la fame di nutrienti o il caldo, Per esempio, " disse Segatori. "Quando la cellula è esposta allo stimolo, La GFP è espressa ed è possibile rilevare un aumento della fluorescenza cellulare.
"Ma quando togli lo stimolo, il decadimento del segnale non riflette necessariamente il decadimento dello stimolo; riflette la stabilità del giornalista GFP, " ha detto. "Quello che abbiamo fatto è creare un circuito genetico in cui l'espressione di GFP viene attivata sotto stimolo, ma quando lo stimolo è spento, il NanoDeg degrada la GFP molto rapidamente. Ciò aumenta la sensibilità e la risoluzione dinamica di un circuito genetico sintetico".