Sbirciare dentro una cellula biologica rivela un vivace mondo microscopico. I cavalli da lavoro in questo regno sono strutture specializzate chiamate organelli che svolgono funzioni cellulari vitali. Curiosamente, alcuni organelli sfidano le convenzioni accettate:invece di essere racchiusi all'interno di una membrana protettiva, sono senza membrana e assumono la forma di goccioline liquide isolate. Le regole che governano la formazione di queste goccioline, un processo chiamato "separazione di fase liquido-liquido", rappresentano un'area di ricerca nuova e molto perseguita.
Un team di scienziati della Texas A&M Engineering, dell'Università del Delaware e della Rutgers University ha scoperto che gli amminoacidi (residui) che compongono le proteine all'interno delle goccioline interagiscono in molti più modi di quanto attualmente riconosciuto. Queste interazioni, mostrano, facilitano l'assemblaggio delle proteine e, infine, la separazione della fase liquido-liquido in goccioline.
I ricercatori hanno pubblicato i loro risultati sulla rivista Nature Chemistry .
Il loro lavoro rappresenta un passo avanti verso l'ampliamento della comprensione della biologia cellulare, lo sviluppo di trattamenti per malattie che coinvolgono aggregati proteici patologici, come l'Alzheimer e il Parkinson, e la creazione di nuovi materiali morbidi bioingegnerizzati.
La recente scoperta di goccioline liquide all'interno delle cellule viventi è stata fatta per la prima volta nelle cellule germinali di un verme che vive nel suolo, Caenorhabditis elegans (C. elegans). All'interno dell'embrione del verme, strutture prive di membrana chiamate granuli P svolgono funzioni riproduttive essenziali. Dopo aver analizzato ulteriormente, i ricercatori hanno scoperto che i granuli di P erano privi di membrane e potevano gocciolare, unirsi o dissolversi, avendo caratteristiche proprio come i liquidi. Inoltre, questi granuli di P potrebbero mantenere la loro integrità all'interno del citoplasma gelatinoso, proprio come le goccioline di olio nell'acqua.
"C'è stato un cambiamento fondamentale nel 2009 nel pensare alla compartimentazione cellulare in termini di comparsa di strutture simili a goccioline", ha affermato il dottor Jeetain Mittal, professore presso il Dipartimento di ingegneria chimica Artie McFerrin e autore senior. "La maggior parte dei biologi ha iniziato ad accettare che la separazione di fase non è un'eccezione ma la regola con cui le cellule biologiche suddividono in compartimenti unità funzionali diverse dagli organelli legati alla membrana."
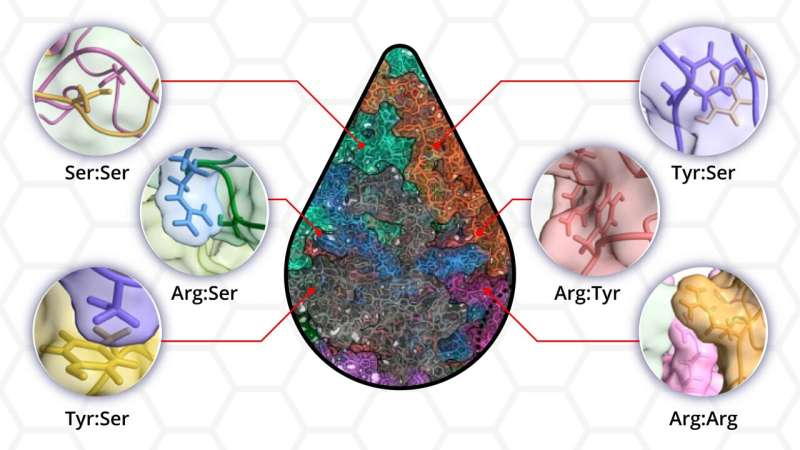
Ma come fanno solo proteine specifiche che si muovono nel citoplasma insieme a milioni di altre ad assemblarsi in goccioline funzionali? Le prove indicano che le proteine intrinsecamente disordinate o quelle prive di una struttura tridimensionale ordinata possono essere essenziali nella separazione di fase. Tuttavia, le interazioni tra proteine disordinate che orchestrano la separazione di fase devono ancora essere completamente delineate.
"Non abbiamo ancora un'idea molto chiara di quali amminoacidi all'interno delle regioni disordinate forniscano la forza trainante per la separazione di fase", ha affermato Shiv Rekhi, uno studente laureato del laboratorio di Mittal e autore principale. "Volevamo andare oltre le regole stabilite, mostrare comunque la separazione delle fasi e quindi quantificare il modo in cui ciascun amminoacido contribuisce al processo."
Per la loro ricerca, il team ha utilizzato una proteina sintetica disordinata con sequenze di aminoacidi che ricordano le proteine presenti in natura. I ricercatori hanno poi creato varianti proteiche rimuovendo o aggiungendo un tipo specifico di amminoacido e valutando se si verificava ancora la condensazione in goccioline. Con i loro collaboratori hanno eseguito esperimenti di microscopia e di torbidità per valutare la natura fisica della gocciolina arricchita di proteine. Infine, utilizzando simulazioni su larga scala, Rekhi ha esplorato come le interazioni atomiche tra gli amminoacidi all'interno della sequenza proteica si traducono nella formazione di goccioline liquide osservate sperimentalmente.
"Un punto di vista prevalente è che la tirosina e/o l'arginina siano necessarie per la separazione di fase. Lo abbiamo testato direttamente creando varianti proteiche in cui abbiamo rimosso questi residui e abbiamo comunque ottenuto la separazione di fase", ha detto Rekhi. "Questo e molti altri esperimenti simili ci hanno dimostrato che la separazione di fase può avvenire senza molti residui che la gente ritiene necessari."
I ricercatori hanno scoperto che tutte le 12 varianti proteiche tranne una mostravano una separazione di fase, sottolineando la presenza di molteplici interazioni tra i residui di amminoacidi che compongono la proteina disordinata.
"Per un po', gli esperti del settore hanno dato per scontato che un insieme limitato di regole potesse descrivere la formazione delle goccioline. Abbiamo dimostrato che tutto nella sequenza proteica è importante", ha affermato Mittal. "Il nostro articolo stabilisce che il linguaggio molecolare della separazione di fase è molto più ricco e complesso."
Altri contributori alla ricerca includono Cristobal Garcia Garcia e la Dott.ssa Kristi L. Kiick dell'Università del Delaware; Mayur Barai e il dottor Benjamin Schuster della Rutgers, Università statale del New Jersey.
Ulteriori informazioni: Shiv Rekhi et al, Espansione del linguaggio molecolare della separazione di fase liquido-liquido delle proteine, Chimica naturale (2024). DOI:10.1038/s41557-024-01489-x
Informazioni sul giornale: Chimica della Natura
Fornito dal Texas A&M University College of Engineering