Le proteine antiche possono offrire indizi sull'ingegneria delle proteine per resistere alle alte temperature richieste nelle applicazioni industriali. Credito:Rensselaer Polytechnic Institute
Le proteine antiche possono offrire indizi su come progettare proteine in grado di resistere alle alte temperature richieste nelle applicazioni industriali, secondo una nuova ricerca pubblicata nel Atti dell'Accademia Nazionale delle Scienze . I ricercatori hanno utilizzato esperimenti per esaminare le differenze critiche tra 15 proteine della famiglia della tioredossina, comprese sette sequenze proteiche estinte che risalgono a più di 4 miliardi di anni e sono state resuscitate utilizzando ricostruzioni di sequenze ancestrali.
"Nelle applicazioni industriali, le proteine potrebbero svolgere parte del lavoro delle sostanze chimiche con meno energia e meno tossicità, ma devono essere in grado di resistere alle temperature più elevate dei processi industriali, " disse George Makhatadze, Professore di costellazione di biocomputazione e bioinformatica e membro del Centro per le biotecnologie e gli studi interdisciplinari del Rensselaer Polytechnic Institute. "Questa ricerca suggerisce che i metodi di ricostruzione ancestrali possono essere utilizzati per progettare proteine che si dispiegano più lentamente, offrendo una maggiore utilità, a temperature più elevate."
Gli esperimenti hanno mostrato che la differenza di stabilità tra proteine della stessa famiglia è causata principalmente da differenze nell'energia richiesta per dispiegare le proteine, una scoperta che sostiene una teoria di vecchia data nota come "principio della minima frustrazione, " proposto dai fisici circa 30 anni fa.
Le proteine sono catene molecolari in cui ogni anello è uno dei 20 amminoacidi. Una volta montata la catena, varie forze lungo la sua lunghezza interagiscono, facendo girare e girare la corda, e infine piegare in una forma tridimensionale. La proteina può svolgere la sua funzione solo se correttamente ripiegata. La maggior parte delle proteine rimane ripiegata entro un determinato intervallo di temperatura, pH, o condizioni di pressione, rottura se sottoposto a condizioni al di fuori di queste tolleranze.
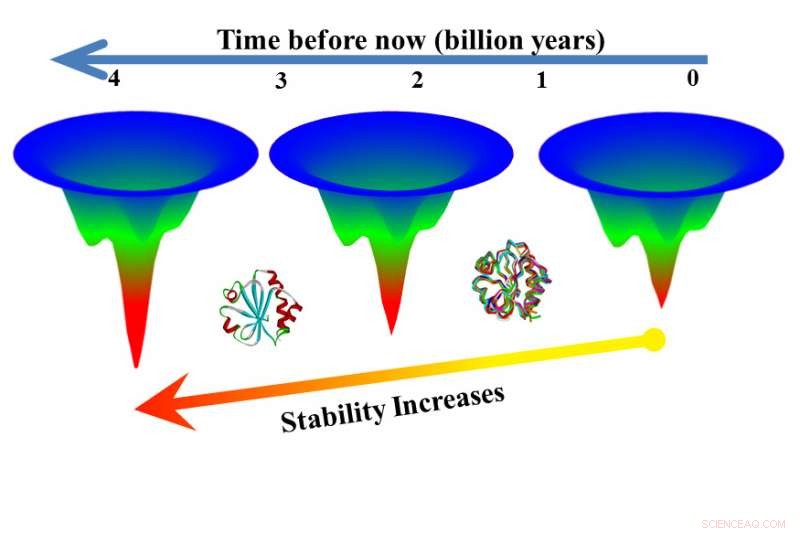
Non sono note tutte le regole che governano il ripiegamento delle proteine, e Makhatadze volevano capire come le proteine all'interno della stessa famiglia, con struttura simile, sono in grado di svolgere la stessa funzione di sostentamento della vita in ambienti termici molto diversi. tioredossina, Per esempio, sono presenti in tutti gli organismi, da quelli che vivono vicino a bocche idrotermali bollenti alle gelide acque artiche.
Una regola nota aiuta a spiegare perché esiste un numero astronomico di sequenze possibili per proteine con centinaia e persino migliaia di collegamenti, ma solo un piccolo sottoinsieme di quelle possibili sequenze si trova in natura. Questa regola, il principio della minima frustrazione, postula che la natura scelga solo quelle sequenze che si piegano in modo più efficiente, riducendo le interazioni indesiderate tra gli amminoacidi e producendo più velocemente, meno frustrato, modelli pieghevoli.
Per essere coerenti con il principio della minima frustrazione, Makhatadze ha detto, proteine con struttura simile ma diversa stabilità termodinamica dovrebbero ripiegarsi lungo lo stesso schema efficiente, ma quelli con una maggiore capacità di tollerare il calore dovrebbero impiegare più tempo a svilupparsi. Esperimenti, intrapresa prima con otto tioredossine moderne, dimostrato l'ipotesi corretta.
"Abbiamo testato i tassi di piegatura tra le tioredossine, una famiglia di proteine che svolgono la stessa funzione ma, poiché funzionano in condizioni termiche diverse, devono essere diverse in termini di termodinamica, " ha detto Makhatadze. "E quello che abbiamo osservato è che per queste proteine, si piegano infatti con la stessa velocità, ma si svolgono con un ritmo diverso, che è quello che avevamo previsto".
Nel passaggio successivo, i ricercatori hanno testato versioni estinte di tioredossine ottenute utilizzando una tecnica chiamata ricostruzione della sequenza ancestrale. Le versioni estinte si sono sviluppate più lentamente delle versioni moderne, in alcuni casi piegando 3, 000 volte più lentamente di una controparte moderna.
"Qui abbiamo due versioni di una proteina della stessa famiglia e una si è sviluppata in sette secondi, l'altro in sei ore, " Ha detto Makhatadze. "Ciò significa che puoi ottenere una funzione utile dalla proteina per sei ore contro sette secondi. Ciò dimostra che la ricostruzione della sequenza ancestrale può essere una via per le proteine che sono più stabili alle alte temperature".
La scoperta è supportata da ricerche precedentemente pubblicate e dati geochimici che indicano che la Terra e i suoi oceani erano più caldi nel passato antico.
"La ricerca precedente supporta la scoperta che le proteine più vecchie sono più stabili, ma questa nuova ricerca mostra che queste antiche proteine sono più stabili perché si dispiegano più lentamente, " disse Makhatadze.
"La prova del principio della minima frustrazione nell'evoluzione dei paesaggi di ripiegamento delle proteine" può essere trovata utilizzando l'identificatore di oggetto digitale DOI:10.1073/pnas.1613892114. La ricerca è stata sostenuta dalla National Science Foundation. Makhatadze è stato affiancato nella ricerca da Fanco Tzul, un associato di ricerca post-dottorato, e studente laureato Daniel Vasilchuk.
La ricerca di Makhatadze è resa possibile dalla visione di The New Polytechnic, un paradigma emergente per l'istruzione superiore che riconosce che le sfide e le opportunità globali sono così grandi che non possono essere adeguatamente affrontate nemmeno dalla persona più talentuosa che lavora da sola. Rensselaer funge da crocevia per la collaborazione, lavorando con partner di diverse discipline, settori, e regioni geografiche, per affrontare sfide globali complesse, utilizzando gli strumenti e le tecnologie più avanzate, molti dei quali sono sviluppati a Rensselaer. La ricerca a Rensselaer affronta alcune delle sfide tecnologiche più urgenti del mondo, dalla sicurezza energetica e lo sviluppo sostenibile alla biotecnologia e alla salute umana. Il Nuovo Politecnico trasforma l'impatto globale della ricerca, nella sua pedagogia innovativa, e nella vita degli studenti di Rensselaer.